
题目列表(包括答案和解析)
1.下列对“摩尔(mol)”的叙述不正确的是 ( )
A.摩尔是一个物理量
B.摩尔是一个单位,用于计量物质所含微观粒子的多少
C.摩尔既能用来计量纯净物,又能用来计量混合物
D.1mol任何气体所含的气体分子数目都相等
22. (13分) 将不同量的H2O(气) 和CO 气体分别通入到一体积为l L的恒容密闭容器中进行反应:H2O (g) + CO( g)
 CO2
(g) +H2(g),得到以下三组数据,据此回答下列问题:
CO2
(g) +H2(g),得到以下三组数据,据此回答下列问题:
|
实验组 |
温度 |
起始量 |
平衡量 |
达到平衡所需时间 |
||
|
H2O |
CO |
H2 |
CO |
|||
|
1 |
650℃ |
1 mol |
2 mol |
0.8 mol |
1.2 mol |
5 min |
|
2 |
900℃ |
0.5 mol |
1 mol |
0.2 mol |
0.8 mol |
3 min |
|
3 |
900℃ |
a |
b |
c |
d |
t |
( 1 ) ①由以上数据,实验1中以v( CO2) 表示的反应速率为 。
②该反应在650℃时平衡常数数值为 ,该反应的逆反应为 (填“吸” 或“放”)热反应。
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t <3min,则a.b 应满足的关系是 。
(2)下图1.2 表示上述反应在时刻t1达到平衡,在时刻t2因改变某个条件而发生变化的情况:
①图1中时刻t2发生改变的条件可能是 (写一条即可,下同)。
②图2中时刻t2发生改变的条件可能是 。

(3) 在850℃时,其平衡常数K = 1, 850℃时在该容器中同时充人1.0molCO,3.0 molH2O,1.0molCO2,5.0molH2,此时反应向 (填“正反应” 或“逆反应”)方向进行,平衡时CO2的物质的量为 。
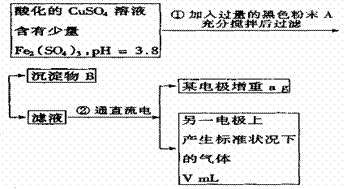 21.(12分)已知在pH为4-5的溶液中,
21.(12分)已知在pH为4-5的溶液中,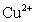 几乎不水解,而
几乎不水解,而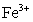 几乎完全水解.某学生拟用电解
几乎完全水解.某学生拟用电解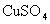 溶液的方法测定铜的相对原子质量.其实验流程如下图所示:
溶液的方法测定铜的相对原子质量.其实验流程如下图所示:
试回答下列问题:
(1)步骤①所加入的A的化学式为____ ____;加入A的作用是__________________
________________
_______; 沉淀物B是_____
___(填化学式)。
沉淀物B是_____
___(填化学式)。
(2)步骤②中所用部分仪器如图所示:则A应接直流电 源的________极,B电极上发生的电极反应式为__________ __________________。
(3)下列实验操作属必要的是_____ __(填字母)。
A.称量电解前电极的质量
B.电解后电极在烘干前,必须用蒸馏水冲洗
C.刮下电解后电极上的铜,并清洗.称量
D.电极在烘干称重的操作中必须按:烘干→称重→再烘干→再称重进行两次
E.在空气中烘干电极,必须采用低温烘干法
(4)电解后向溶液中加入石蕊试液,观察到的现象是_________________________。
(5)铜的相对原子质量的计算式为____ ____。
20.(10分)A.B.C.D.E五种短周期元素,原子序数依次增大,A.E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A.B.C.E四种元素都能与D元素形成原子个数比不相同的常见化合物。回答下列问题:
(1)常温下,若Y的水溶液的pH为5。则其原因(用离子方程式表示)为 。
(2)由A、B、D、E四种元素组成的某无机化合物,受热易分解。写出少量该化合物溶液与足量的Ba(OH)2溶液反应的离子方程式 。
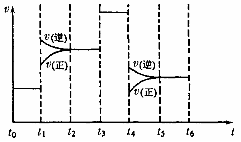 (3)化学反应3A2(g)+C2(g)
(3)化学反应3A2(g)+C2(g) 2CA3(g)。
2CA3(g)。
当反应达到平衡时不断改变条件(不改变 A2.C2
和CA3的量),右图表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是 。温度为T℃时,将4amolA2和2a molC2放人1L密闭容器中,充分反应后测得C2的转化率为50%,则反应的平衡常数为 。
18.(10分)A,B,C,D是四种短周期元素,它们的原子序数依次增大,其中A、C及B、D分别是同一主族元素,B、D两元素质子数之和是A、C两元素质子数之和的两倍,又知四种元素的单质中有两种气体.两种固体。
(1)A元素名称____ ___;D元素在周期表中的位置___ ______;
(2)B.C.D三种元素形成的离子半径由大到小顺序 ;
(3)写出两种均含A、B、C、D四种元素的化合物相互间发生反应,且生成气体的离子方程式______________________________________________ __;该反应中反应物(固态时)含有的化学键类型:_________________________。
(4)用A元素的单质与B元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的金属惰性电极浸入KOH溶液,两极均有特制的防止透过的隔膜,在一极通入A的单质,另一极通入B的单质,写出该电池发生的电极反应式:
通A极___________________ ____;通B极______ _________________。
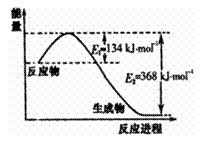 19.(9分)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产.生活中有着重要作用。请回答:
19.(9分)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产.生活中有着重要作用。请回答:
(1)右图是1molNO2和1molCO反应生成CO2和NO过
程中能量变化示意图,请写出NO2和CO反应的热
化学方 。
(2)在固定体积的密闭容器中,进行如下化学反应:
N2(g)+3H2(g)  2NH3(g),其化学平衡常数K与温度t的关系如下表:
2NH3(g),其化学平衡常数K与温度t的关系如下表:
|
t/K |
298 |
398 |
498 |
… |
|
K/(mol·L-1)-2 |
4.1×106 |
K1 |
K2 |
… |
完成下列问题:
①比较K1.K2的大小;K1 K2(填“>”.“=”或“<”)。
②判断该反应达到化学平衡状态的依据是 (填序号)。
A.2v(H2)(正)=3v(NH3)(逆) B.2v(N2)(正)=v(H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
17.在25℃时,密闭容器中X.Y.Z三种气体的初始浓度和平衡浓度如下表:( )
|
物质 |
X |
Y |
Z |
|
初始浓度/mol·L-1 |
0.1 |
0.2 |
0 |
|
平衡浓度/mol·L-1 |
0.05 |
0.05 |
0.1 |
下列说法错误的是: ( )
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y 2Z,其平衡常数为1600(mol·L-1)-2
2Z,其平衡常数为1600(mol·L-1)-2
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
第II卷(非选择题,共54分)
16.某温度下,在密闭容器中发生如下反应:2A(g)+B(g) 2C(g),若开始时充入2mol C气体,达到平衡时,混合气体的压强比起始时增大了20%;若开始时只充入2molA和1mol B 的混合气体,达到平衡时A的转化率为 ( )
2C(g),若开始时充入2mol C气体,达到平衡时,混合气体的压强比起始时增大了20%;若开始时只充入2molA和1mol B 的混合气体,达到平衡时A的转化率为 ( )
A.20% B.40% C.60% D.80%
15.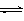 可逆反应mA(g) nB(g)+pC(s) △H=Q, 温度和压强的变化对正、逆反应速率的影响分别符合右图中的两个图像,以下叙述正确的是: ( )
可逆反应mA(g) nB(g)+pC(s) △H=Q, 温度和压强的变化对正、逆反应速率的影响分别符合右图中的两个图像,以下叙述正确的是: ( )
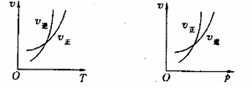 A.m>n,
Q>0
A.m>n,
Q>0
B.m>n+p,Q>0
C.m>n,Q<0
D.m<n+p, Q <0
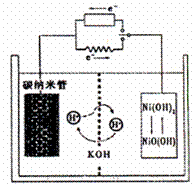
14.一种碳纳米管(氢气)二次电池原理如右图,
该电池的电解质为6mol·L-1KOH溶液,下
列说法不正确的是 ( )
A.储存H2的碳纳米管放电时为负极,充电时
为阴极
B.放电时负极附近pH减小
C.放电时电池正极的电极反应为
NiO(OH)+H2O+e-===Ni(OH) 2+OH-
D.放电时,电池反应为2H2+O2===2H2O
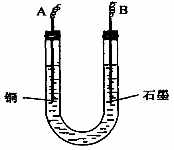
13.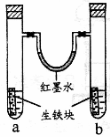 右图装置中,U型管内为红墨水,a.b试管内分别盛有食盐水和
右图装置中,U型管内为红墨水,a.b试管内分别盛有食盐水和
氯化铵溶液,各加入生铁块,放置一段时间。下列有关描述错误的
是 ( )
A.生铁块中的碳是原电池的正极
B.红墨水柱两边的液面变为左低右高
C.两试管中相同的电极反应式是:Fe -2e-=Fe2+
 D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com