
题目列表(包括答案和解析)
5.能在溶液中大量共存,加入(NH4)2Fe(SO4)2·6H2O晶体后仍能大量存在的离子组是
A.Na+、H+、Cl-、NO3- B.K+、Ba2+、OH-、I-
C.Na+、Mg2+、Cl-、SO42- D.Cu2+、S2-、Br-、ClO-
4.下列有关Na2CO3和NaHCO3性质的比较中,不正确的是
A.对热稳定性:Na2CO3 >NaHCO3 B.常温时水溶性:Na2CO3 >NaHCO3
C.与稀盐酸反应的快慢:Na2CO3<NaHCO3 D.相对分子质量:Na2CO3>NaHCO3
3.下列说法不正确的是
A.工业上冶炼铁是在硬质玻璃管中进行的
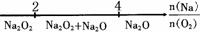 B.工业上水泥的生产是在水泥回转窑中进行的
B.工业上水泥的生产是在水泥回转窑中进行的
C.工业上制备硝酸需要用到热交换器
D.工业上获得精铜要在电解装置中进行
2.金属材料在日常生活以及生产中有着广泛的运用。下列关于金属的一些说法不正确的是
A.合金的性质与其成分金属的性质不完全相同
B.工业上金属Mg、Al都是用电解熔融的氯化物制得的
C.金属冶炼的本质是金属阳离子得到电子变成金属原子
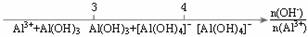 D.越活泼的金属越难冶炼
D.越活泼的金属越难冶炼
1.下列物质与其用途相符合的是

 ①N2-保护气 ②SiO2-光导纤维
①N2-保护气 ②SiO2-光导纤维
③AgI-人工降雨 ④碘-预防甲状腺肿大
⑤Al2O3-耐火材料 ⑥NaClO-消毒剂
A.②③④⑤⑥ B.①②③④⑤ C.②③④⑤ D.全部
(二)(1)某学生用手盘天平称量一个小烧杯的质量,如小烧杯的质量为32.6g,用“↓”表示托盘上放砝码,“↑”表示从托盘天平上取砝码,请用箭头在下表中填空,表示称量过程,并在图32所示的游码尺上画出游码的位置(画“|”表示)。
|
砝码质量/g |
50 |
20 |
20 |
10 |
5 |
|
取用砝码情况 |
|
|
|
|
|
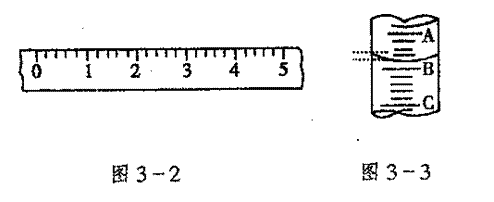
(2)图3-3表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为 4,量筒中的液体的体积是 mL。
(3)配制0.5mol·L-1NaOH溶液200mL所需的玻璃仪器为 。
27.(13分)现在浓度为0.1mol·L-1的五种电解质溶液:①Na2CO3;②NaHCO3;③NaAlO2
④CH3COONa;⑤NaoH。已知:CO2+3H2O+2AlO2-==2Al(OH)3↓+CO2-3
(1)这五种溶液的pH由小到大的顺序是 (填编号);
(2)将五种溶液稀释相同的倍数时,其pH变化最大的是 (填编号);
(3)混合碳酸(H2CO3)溶液和NaAlO2溶液,试写出可能发生的化学反应方程式:
。
(4)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
|
实验编号 |
HA物质的量浓度(mol/L) |
NaOH物质的量浓度(mol/L) |
混合溶液的pH |
|
甲 |
0.20 |
0.20 |
Ph=a |
|
乙 |
0.10 |
0.10 |
pH=8.00 |
不考虑乙组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA是
强酸还是弱酸 ;
乙组实验所得混合溶液中由水电离出的c(OH-)= mol/L。
求出乙组混合溶液中下列算式的值,要求写出推理、计算过程。
I.c(Na+)-c(A-)
II.c(OH-)-c(HA)
17.下列溶液中有关物质的量浓度关系正确的是 ( )
A.10℃时,pH=12的NaOH溶液与40℃时pH=12的NaOH溶液中:c(OH-)相等
B.25℃时pH=10的NaOH溶液与pH=10的氨水中:c(Na+)=c(NH+4)
C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:
c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)
D.0.1mol·L-1(NH4)2Fe(SO4)2溶液中:
C(NH+4)+c(Fe2+)+c(NH3·H2O)=0.3mol·L-1
18.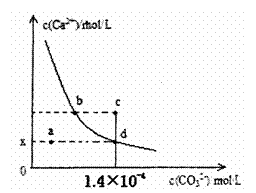 室温时,CaCO3在水中的沉淀溶解平衡曲线如图
室温时,CaCO3在水中的沉淀溶解平衡曲线如图
所示。已知CaCO3的溶度积(室温)为2.8×10-9,
下列说法中不正确的是 ( )
A.x的数值为2×10-5
B.c点时有CaCO3生成
C.加入蒸馏水可使溶液由d点变成 a点
D.b点与d点对应的溶度积相等
19.在标准状况下,进行甲、乙、丙三组实验:三组各取60mL同浓度盐酸溶液,加入同一种镁铝合金粉末,产生气体,有关数据列表如下:
|
实验序号 |
甲 |
乙 |
丙 |
|
合金质量/mg |
510 |
770 |
918 |
|
气体体积/mL |
560 |
672 |
672 |
则下列说法正确的是 ( )
A.甲组和乙组的实验中,盐酸均是过量的
B.盐酸的物质的量浓度为0.8mol·L-1
C.合金中镁铝的物质的量之比为1:1
D.丙组中铝的物质的量为0.009mol
20.关于下列四个图像的说法中正确的是 ( )
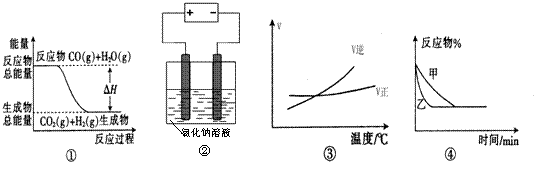
A.图①表示可逆反应“CO(g)
+ H2O(g) CO2(g)+H2(g)”中的ΔH小于0
CO2(g)+H2(g)”中的ΔH小于0
B.图②是在电解氯化钠稀溶液的电解池中,阴、阳极产生气体体积之比一定为1︰1
C.图③表示可逆反应“A2(g)+3B2(g) 2AB3(g)”的ΔH大于0
2AB3(g)”的ΔH大于0
D.图④表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
21.如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴
入酚酞溶液,在F极附近显红色。则以下说法不正确的是 ( )

A.电源B极是正极
B.(甲)、(乙)装置的C、D、E、F电极均有单质生成,其物质的量比为1∶2∶2∶2
C.欲用(丙)装置给铜镀银,G应该是Ag,电镀液选是AgNO3溶液
D.装置(丁)中X极附近红褐色变浅,说明氢氧化铁胶粒带负电荷
 22.将某稀硫酸和稀硝酸的混合溶液200mL。平均分成两等份。向其中一份中逐渐加入铜粉,最多能溶解19.2%;向另一份中逐渐加入铁粉,
22.将某稀硫酸和稀硝酸的混合溶液200mL。平均分成两等份。向其中一份中逐渐加入铜粉,最多能溶解19.2%;向另一份中逐渐加入铁粉,
产生气体的量随铁粉质量增加的变化如下图所
示(已知硝酸均只被还原为NO气体)。下列
分析或结果不正确的是 ( )
A.第二份溶液中最终的溶质为FeSO4
B.OA段产生的气体是NO,AB段的反应为
Fe+2Fe3+=3Fe2+,BC段产生的气体是H2
C.原混合酸中NO-3的物质的量共为0.4mol
D.原混合酸中H2SO4的物质的量浓度为5mol·L-1
第Ⅱ卷(填空题)
本大题包括5个小题,共50分
23.(8分)某反应中反应物与生成物有:AsH3、H2SO4、KbrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知在KBrO3在反应中得到电子,则该反应的还原剂是 。
(2)已知0.2mol KBrO3在反应中得到1mol电子生成X,则X的化学式为 。
(3)根据上述反应可推知 。
a.氧化性:KbrO3>H3AsO4 b.氧化性:H3AsO4>KbrO3
c.还原性:X<AsH3 d.还原性:X>AsH3
(4)将氧化还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目:
+
24.(12分)短周期主族元素A、B、C、D、E的原子序数依次增大,它们的原子核外电子
层数之和为10;B的化合物种类繁多,数目庞大。C、D是空气中含量最多的两种元素;
D、E两单质在不同条件下以应可以生成两种不同的离子化合物。
(1)写出E的单质与A、D两元素形成的常见化合物反应的离子方程式; 。
(2)由B、D两种元素组成的化合物,该化合物是大气温室效应的主要气体,写出该化合物的电子式 ,属 晶体。B的相对分子质量最小的氢化物的燃烧热为890.3kJ·mol-1写出其燃烧热化学方程式; 。
(3)由A、C、D三元素形成的常见盐酸溶液呈 性(填“酸”、“中”、“碱”),其原因用离子方程式表示为 。
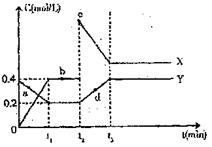 (4)X、Y是由C、D两元素组成的两种化合物,
(4)X、Y是由C、D两元素组成的两种化合物,
且C、D在X、Y中的价态相同,某温度下
可相互转化的量变关系如图所示:
①X的化学式是 。
②图中a、b、c、d四点中,表示反应处于
平衡状态的是 。
③反应进行到t2时刻,改变的条件可能是
。
25.(7分)设计出燃料电池使汽油氧化直接产生电流是本世纪最富有挑战性的课题之一。
最近有人制造了一种燃料电池,一个极通入空气,另一个极通入汽油蒸气,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-,回答如下问题:
(1)以丁烷为汽油代表,这个电池放电时发生的化学反应的方程式是 ;
(2)这个电池负极发生的反应是:C4H10+13O2-26e-===4CO2+5H2O,正极发生的反应是:
;固体电解质里O2-的移动方向是: ;
向外电路释放的电子的电极是: ;
(3)人们追求燃料电池氧化汽油而不在内燃机里燃烧汽油生动力的主要原因是:
;
(4)汽油燃料电池最大的障碍是氧化反应不完全产生 堵塞电极的气体通道,人有估计,完全避免这种副反应至少还需10年,这正是新一代化学家的历史使命。
26.(10分)(一)在配制物体的量浓度溶液时,下列操作出现的后果是(填:“溶液浓度不
准确”、“偏低”、“偏高”、“无影响”):
(1)配制氢氧化钠溶液时,称取已吸潮的氢氧化钠固体。 。
(2)配制氯化钠溶液时,容量瓶中有少量水。 。
(3)配制好溶液后,容量瓶未塞好,洒出一些溶液。 。
(4)发现溶液液面超过刻度线,用吸管吸出少量水,使液面降至刻度线。 。
16.钢铁“发蓝”是将钢铁制品浸到某些氧化性的溶液中,在钢铁的表面形成一层四氧化铁的技术过程。其中一种办法是将钢铁制品浸到亚硝酸钠和浓氢氧化钠的混合溶液中加热到130℃反应。其过程可以用如下化学方程式表示:
① 3Fe+NaNO2+5NaOH = 3Na2FeO2+H2O+NH3↑;
② 6Na2FeO2+NaNO2+5H2O = 3 Na2Fe2O4+ NH3↑+7NaOH;
③ Na2FeO2+ Na2Fe2O4+2H2O = Fe3O4+4NaOH;
下列说法不正确的是 ( )
A.该生产过程会产生污染
B.反应②中的氧化剂是NaNO2
C.整个反应过程中每有16.8gFe参加反应转移0.8mol电子
D.反应①②③均是氧化还原反应
15.镁及其化合物一般无毒(或低毒)、无污染,且镁原电池放电时电压高而平稳,使镁原电池越来越成为人们研制绿色原电池的关注焦点。其中一种镁原电池的反应为:
x Mg+Mo3S4 Mgx Mo3S4 ;在镁原电池放电时,下列说法错误的是 ( )
 A.Mg2+向正极迁移
A.Mg2+向正极迁移
B.正极反应为:Mo3S4+2xe- = Mo3S42x-
C.Mo3S4发生氧化反应
D.负极反应为:xMg - 2xe- = xMg2+
14.下列离子方程式书写正确的是 ( )
A.KI溶液中滴加过氧化氢溶液:2I-+H2O2=I2+O2+2H+
B.石灰乳中通入氯气:Cl2+2OH-=Cl-+ClO-+H2O
|
C.用石墨电极电解硝酸银溶液:4Ag++2H2O==== 4Ag↓+O2↑+4H+
D.向烧碱溶液中滴加过理的碳酸氢钙溶液:
Ca2++2HCO-3+2OH-=CaCO3↓+2H2O+CO2-3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com