
题目列表(包括答案和解析)
8. 下列各组离子在指定条件下,-定能大量共存的是( )
下列各组离子在指定条件下,-定能大量共存的是( )
①能使红色石蕊试纸变蓝的溶液中:K+、Na+、CO32-、NO3-、AlO2-
②c(H+)=10-1mol/L的溶液中:Cu2+、Al3+、SO42-、NO3-
③能使碘化钾淀粉试纸变蓝的溶液中:Na+、NH4+、S2-、Br-
④水电离出的c(H+)=10-12mol/L的溶液中:Na+、Mg2+、Cl-、SO42-
⑤在加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO42-、NO3-
⑥在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN-
⑦含有大量S2-的溶液:Na+、C1O-、C1-、CO32-
⑧能使pH试纸变红的溶液:NH4+、Na+、NO3-、HCO3-
A.①② B.①③ C.②④ D.②⑤⑥
7、能正确表示下列反应的离子方程式是( )
A.氨水中通入过量CO2:2NH3·H2O + CO2 = 2NH4+ + CO32- + H2O
B.氯化亚铁溶液中加入硝酸:Fe2+ + 4H+ + NO3- = Fe3+ + 2H2O + NO↑
C.将标准状况下112 mL氯气通入10 mL 1 mol·L-1的溴化亚铁溶液中:
2Fe2+ + 4Br-+ 3Cl2 = 2Fe3+ + 6Cl- + 2Br2
D.在碳酸氢钙溶液中加入过量苛性钾溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O
6、室温下,下列混合溶液中,各离子浓度的关系正确的是
A.PH = 12的氨水溶液与pH=2的盐酸溶液等体积混合c(NH4+)>c(Cl-)>c(OH-)>c(H+)
B.浓度均为0.1 mol·L-1的硫酸氢铵溶液与氢氧化钠溶液等体积混合
c(Na+)>c(SO42-)>c(NH4+)>c(H+)>c(OH-)
C.浓度均为0.1 mol·L-1的小苏打溶液与烧碱溶液等体积混合
c(Na+)+c(H+)=2c(CO32-)+c(OH-)
D.浓度均为0.1 mol·L-1的醋酸溶液与氢氧化钠溶液等体积混合
c(Na+)=c(CH3COO-)>c(OH-)=c(H+)
5、用CH4催化还原NOx可以消除氮氧化物的污染。例如:
① CH4(g) + 4NO2(g) = 4NO(g) + CO2(g) + 2H2O(g) △H =-574 kJ·mol-1
② CH4(g) + 4NO(g) = 2N2(g) + CO2(g) + 2H2O(g) △H =-1160 kJ·mol-1
下列说法不正确的是
A.由反应①可推知:CH4(g) + 4NO2(g) = 4NO(g) + CO2(g) + 2H2O(l) △H <-574 kJ·mol-1
B.反应①②转移的电子数相同
C.0.2mol CH4 还原 NO2至 N2,放出的热量为 173.4 kJ
D.若用标准状况下4.48 L CH4 还原 NO2至 N2,整个过程中转移的电子总数为1.60 mol
4、阿伏加德罗常数约为6.02×1023 mol-1。下列叙述中正确的是
A.32 g含有少量臭氧的氧气中,共含有氧原子数为2×6.02×1023
B.标准状况下,11.2 L四氯化碳含有的分子数为0.5×602×1023
C.5.6 g铁粉完全溶于硝酸,失去的电子数一定为0.3×6.02×1023
D.1 L0.5 mol/L Na2CO3 溶液中含有的CO32-数目为0.5×6.02×1023
3、下列说法正确的是
A.16O2与18O2互为同位素,H2O、D2O、T2O互为同素异形体,N60和N2互为同系物
B.除稀有气体外的非金属元素都能生成不同价态的含氧酸
C.非金属元素R所形成的含氧酸盐(MaROb)中的R元素必定呈现正价
 D.Ca的原子结构示意图为
D.Ca的原子结构示意图为
2、下列实验操作中,仪器需插入液面下的有:①制备Fe(OH)2,用胶头滴管将NaOH溶液
滴入FeSO4溶液中;②制备氢气,简易装置中长颈漏斗的下端管口;③分馏石油时测量温度所用的温度计;④用乙醇制备乙烯时所用的温度计;⑤用水吸收氨气时的导气管;⑥向试管中的BaCl2溶液滴加稀硫酸
A.③⑤⑥ B.②⑤ C.①②④ D.①②③④⑤⑥
1、下列叙述正确的是
A.二氧化硅是人类将太阳能转换为电能的常用材料
B.二氧化硫在接触室被氧化成三氧化硫,在吸收塔内用水吸收制成浓硫酸
C.为检验酸性溶液中的Cl-和SO42-,先加BaCl2溶液,滤去沉淀后再加AgNO3溶液
D.分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
|
27.(12分)进行胃部透视时,常在检查之前服用“钡餐”,其主要成分是硫酸钡。
(1)25℃时,已知胃液的pH在0.9-1.5之间,请问___ 。(填“能”或“不能”)用碳酸钡代替硫酸钡作为“钡餐”使用,简述你做出判断的理由_ 。
(2)当人体中Ba2+浓度达到2×10-3mol·L-1时,就会对健康产生危害,若误将氯化钡当做食盐食用,请计算说明是否可以通过服用5%的硫酸钠溶液(约0.36mol·L-1)有效除去胃中的Ba2+。(25℃时,硫酸钡的溶度积常数Ksp=1.1×10-10)
。
 (3)环境监测某工厂废水中Ba2+的浓度。取废水50.00mL,控制适当的酸度加入足量的K2Cr2O7溶液,得BaCrO4沉淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时CrO42-全部转化为Cr2O72-,再加入过量KI溶液,反应液中再滴加0.100mol·L-1Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液36.00mL。已知有关的离子方程式为:
(3)环境监测某工厂废水中Ba2+的浓度。取废水50.00mL,控制适当的酸度加入足量的K2Cr2O7溶液,得BaCrO4沉淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时CrO42-全部转化为Cr2O72-,再加入过量KI溶液,反应液中再滴加0.100mol·L-1Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液36.00mL。已知有关的离子方程式为:
① Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;② I2+2S2O32-=2I-+S4O62-。
试计算该工厂废水中Ba2+的物质的量浓度。

2009学年高三第二次月考
26.(13分)某兴趣小组为验证日常生活用的火柴头上含有KClO3、MnO2、S,设计了以下实验流程图:
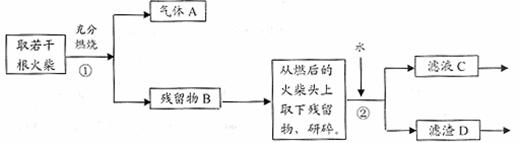
 请回答以下问题:
请回答以下问题:
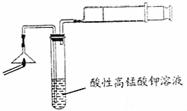
(1)为验证气体A,按右图所示进行实验:若能
观察到 的现象,即可证明火柴头上含有S元素。
(2)写出步骤①中发生反应的化学方程式 。
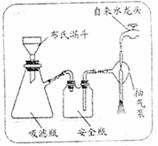 (3)步骤②的实验操作装置如右下图所示,该操
(3)步骤②的实验操作装置如右下图所示,该操
作的名称是 。
(4)要证明火柴头中含有Cl元素的后续实验步
骤是 。
(5)有学生提出检验火柴头上KClO3另一套实验方案:
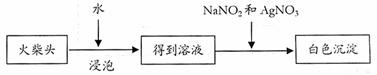
|
充分说明火柴头上KClO3的存在,其理由是 。
(6)该小组猜测滤渣D对双氧水分解制氧气的速率会产生一定的影响,设计并进行了以下5次实验。

|
实验次数 |
H2O2溶液质量分数% |
H2O2溶液用量/毫升 |
物质D用量/克 |
反应温度/℃ |
收集气体体积/毫升 |
所需时间/秒 |
|
① |
30 |
5 |
0 |
85 |
2 |
3.8 |
|
② |
15 |
2 |
0.1 |
20 |
2 |
2.8 |
|
③ |
15 |
2 |
0.2 |
20 |
2 |
2.2 |
|
④ |
5 |
2 |
0.1 |
20 |
2 |
7.4 |
|
⑤ |
30 |
5 |
0 |
55 |
2 |
10.5 |
由上表可知,实验①和⑤能证明温度越高,化学反应速率越快,实验 和
证明物质D的用量越大,反应速率越快。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com