
题目列表(包括答案和解析)
6.把含有少量的HCl、CO2、O2 的干燥的N2 气依次通过足量的过氧化钠与过量的灼热的铜丝,剩余的气体是( ) A.只有N2 B. N2 与 HCl (g) C. N2 和 O2 D. N2、HCl、O2
5.医学研究证明,用放射性135 53I治疗肿瘤可收到一定疗效,下列有关135 53I叙述正确的是( )
A.135 53I是碘的一种同素异形体
B.135 53I是一种新发现的元素
C.135 53I位于元素周期表中第4周期ⅦA族
D.135 53I核内的中子数与核外电子数之差为29
4.下列各组离子一定能大量共存的是( )
A.含有大量Fe3+的溶液中:NH4+、Na+、CI-、SCN-
B.在强碱溶液中:Na+、K+、AlO2-、CO32-
C.在C(H+)=10-13mol·L-1的溶液中:NH4+、Al3+、SO42-、NO3-
D.在pH=1的溶液中:K+、Fe2+、Cl-、NO3-
3. 下列各溶液中,Na+ 物质的量浓度最大是 ( )
A.4L 0.5mol/LNaCl溶液 B.1L 0.3mol/LNa2SO4溶液
C.5L 0.4mol/LNaOH D.2L 0.15mol/LNa3PO4
2.下列化合物,按其晶体的熔点由高到低排列正确的是( )
A.SiO2 CaCl2 CBr4 CF4 B.SiO2 CsCl CF4 CBr4
C.CsCl SiO2 CBr4 CF4 D.CF4 CBr4 CsCl SiO2
1. 下列表达方式正确的是( )
下列表达方式正确的是( )
A.碳-12原子: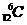 B.硫离子结构示意图:
B.硫离子结构示意图:
C.羟基的电子式::O:H D.HClO的结构式:H-O-Cl
22、(16)Ⅰ. 下面a-e是中学化学实验中常见的几种定量仪器:
a、量筒 b、容量瓶 c、滴定管 d、托盘天平 e、温度计
①使用容量瓶的第一步操作是___________________________________。
②若用上述仪器配制500mL 2mol·L-1的NaCl溶液,还缺少的玻璃仪器是烧杯_________。
③若用上述仪器测定中和热,则缺少的玻璃仪器为烧杯、__________。
④若用上述仪器进行中和滴定,则缺少的仪器是__________。
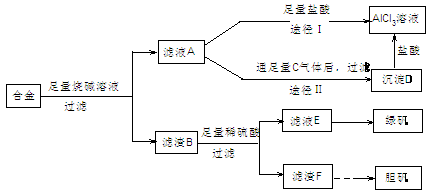
 Ⅱ 某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,以探索工业废料的再利用。其实验方案如下:
Ⅱ 某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,以探索工业废料的再利用。其实验方案如下:
试回答下列问题:
⑴用的器材已有:滤纸、铁架台、铁圈和烧杯,还要补充的玻璃仪器是
。
(2)由滤液A制得AlCl3溶液有途径Ⅰ和Ⅱ两条,你认为合理的是 ,理由是
。
(3)从滤液E中得到绿矾晶体的实验操作是 。
(4)写出用滤渣F制备胆矾晶体的有关化学方程式
。
(5)有同学提出可将方案中最初溶解合金的烧碱改用盐酸,重新设计方案,也能制得三种物质,你认为后者的方案是否更合理 ,理由是 。
21.(10)根据下列框图关系填空,已知反应①、③是我国工业生产中的重要反应,X常温下为无色无味透明液体;C焰色反应火焰呈黄色,J为红褐色沉淀;D、E常温下为气体,且E能使品红溶液褪色;A固体中仅含两种元素,其中金属元素的质量分数约为46.7%。
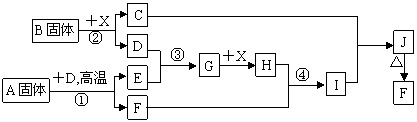
(1)G的化学式为 ;
(2)固体A中所包含的化学键与固体B类似,则A的电子式为 ;
(3)反应②的离子方程式: ;
(4)反应④的离子方程式: ;
(5)已知每生成16 g E,放出106.5 kJ热量,则反应①的热化学方程式为:
20、(10)(1)向MnSO4和硫酸的混合溶液里加入K2S2O8(过二硫酸钾),溶液会发生如下反应:Mn2++S2O82-+H2O→MnO4-+SO42-+H+
该反应常用于检验Mn2+的存在。其特征现象是_______________________,
若反应中有0.1 mol还原剂参加反应,则消耗氧化剂物质的量__________mol。
(2)若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有_________________。
(3)将NaBiO3固体(黄色微溶)加入到MnSO4和H2SO4的混合溶液里加热,固体溶解变为澄清溶液,发生如下反应: NaBiO3+ MnSO4+ H2SO4- Na2SO4+ Bi2(SO4)3+ NaMnO4+ H2O
①配平上述反应的化学方程式,并标出电子转移的方向和数目;
②上述反应中还原产物是
19、(10)某强碱性溶液中可能含有的离子是K+、NH4+、Al 3+ 、AlO2-、SO42- 、SiO32- 、CO32-、Cl-中的某几种离子,现进行如下实验:
①取少量的溶液用硝酸酸化后,加Ba(NO3)2溶液,无沉淀生成。
②另取少量溶液加入盐酸,其现象是:一段时间保持原样后,开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失。
(1)原溶液中肯定存在的离子是______________,肯定不存在的离子是____________
(2)已知一定量的原溶液中加入5 mL 0.2 mol/L盐酸时,沉淀会完全消失,加入足量的硝酸银溶液可得到沉淀0.187 g,则原溶液中是否含有Cl-?_________________。
(3)按照反应顺序逐步书写出②中发生反应的离子反应方程式
①H++OH-=H2O ②
③ ④HCO3-+H+=H2O+CO2 ⑤
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com