
题目列表(包括答案和解析)
19.对羟基苯甲醛是一种合成医药、香料、液晶材料的重要中间体,以对甲基苯酚为主要

原料 合成对羟基苯甲醛的工艺流程如图所示。
(已知对羟基苯甲醛的熔点≥115.5℃,在水中的溶解度为1.38g)

⑴写出反应Ⅱ化学方程式____________________________________________________,
在生产中不直接用氧气氧化对甲基苯酚的原因是____________________________。
⑵写出对羟基苯甲醛在一定条件下与足量氢气反应的化学方程式___________________。
⑶用核磁共振氢谱对产品进行纯度分析,发现核磁共振氢谱上有四个吸收峰,由此可判断产品_______(填纯净或混有杂质)
⑷对羟基苯甲醛有多种同分异构体,其中苯环上只有一个侧链的同分异构体的结构简式为______________________________________________。
⑸在工艺流程中“操作Ⅰ”的方法是_____________,“操作Ⅱ”的方法是_____________,“真空干燥”的主要目的是________________________。
18.硅和氮均是自然界含量丰富的元素,其单质及其化合物在环境、能源及材料科学中有着重要影响和广泛应用。试回答下列问题:
⑴向大气中排放NOx可能导致的环境问题有 。(答两点)已知足量NaOH溶液能完全吸收NO2生成氮的含氧酸盐,试写出该反应的离子方程式
。
⑵光导纤维的使用,让人们的生活更加丰富精彩, 是制备光导纤维的基本原料。
⑶氮化硅陶瓷是一种新型无机非金属材料,其化学式为 ,可由硅粉(用Al2O3和Y2O3作助剂)在氮气中高温烧结而成,氮气在反应中既是反应物,同时又起了_____________作用。由于使用的硅粉表面含二氧化硅,在反应中需加入碳粉。在烧结过程中,二氧化硅、碳、氮气以物质的量之比3:6:2反应生成两种化合物,该反应的化学方程式为 。
⑷硅燃烧放出大量热量,“硅能源”有望成为二十一世纪的新能源。与“氢能源”比较“硅
能源”具有________________________________等更加优越的特点,从而得到全球的关注和期待。
17.铜及其化合物一般都具有特征的颜色,例如Cu、Cu2O呈红色,CuO呈黑色,CuSO4·5H2O呈蓝色等。研究性学习小组甲为检测实验室用H2还原CuO所得红色固体中是否含有Cu2O进行了认真的探究。
Ⅰ.查阅资料:①Cu2O属于碱性氧化物; ②高温灼烧CuO生成Cu2O;③Cu2O在酸性条件下能发生下列反应:Cu2O+2H+=Cu+Cu2++H2O。
Ⅱ.设计实验方案:
方案1:取该红色试样溶于足量的稀硝酸中,观察溶液颜色变化
方案2:取该红色试样溶于足量的稀硫酸中,观察溶液是否呈蓝色
方案3:称得干燥坩埚的质量为a g ,取红色试样置于坩埚中称得总质量为b g,在空气中高温灼烧至质量恒定,称得最后总质量为c g。
⑴请你评价方案1和方案2。如果你认为方案合理,请简述其化学原理;如果你认为该方
案不合理,请简述原因。
方案1 :
方案2 :
⑵方案3中,若确认红色粉末中含有Cu2O,则a、b、c应符合的数学的关系为 ,该实验方案最少得进行 次称量。
Ⅲ.研究性学习小组乙,设计了新的探究方案,拟通过干燥管中CuSO4是否变蓝判断红色固体中是否含有Cu2O,装置如图所示。
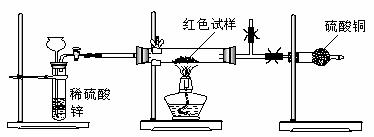
⑶简述该探究方案中,检验气体发生装置气密性的方法(说明操作方法、现象和结论)
。
⑷为确保探究的科学、合理、安全,你认为实验中还应采取的措施有: (填序号)
A.在氢气发生器与硬质玻璃管之间加一个干燥装置
B.加热前先排尽装置中的空气
C.在盛有硫酸铜的干燥管后再连接一个装有碱石灰的干燥管
16.⑴温度计常用来监测或控制化学实验的温度。
①请说明下列实验中温度计的水银球所处的位置:实验室制乙烯_________________,用蒸馏法进行混合物的分离_____________________________。
 ②右图分别是温度计、量筒、滴定管的一部分,下述读数(虚线刻度)及说法正确的是 。
②右图分别是温度计、量筒、滴定管的一部分,下述读数(虚线刻度)及说法正确的是 。
A.①是量筒,读数为2.5mL
B.②是量筒,读数为2.5mL




 C.③是滴定管,读数为3.5mL
C.③是滴定管,读数为3.5mL
D.①是温度计,读数为2.5℃
⑵某同学用右图所示装置,将气体发生装置中产生的氯化
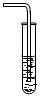 氢直接通入水中配制少量盐酸,结果发生了水的倒吸。
氢直接通入水中配制少量盐酸,结果发生了水的倒吸。
①  在不增加仪器(可选择必需的试剂)的前提下将右图装置稍加改进,即可安全
在不增加仪器(可选择必需的试剂)的前提下将右图装置稍加改进,即可安全
地在试管中用水吸收氯化氢,改进的方法是________
。
②若在烧杯中用水安全地的吸收氯化氢,请在答题卡的矩
形框中绘出合理的吸收装置图。
15.不同的金属在化学反应中表现出来的活泼程度不同,早在1812年瑞典化学家贝采里乌斯根据大量实验现象首先提出了金属活动顺序的概念,后来俄国化学家贝开托夫在大量实验和系统研究之后,于1865年发表了金属活动性顺序:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au 。
⑴金属活动性顺序是学习“金属及其化合物”的重要工具,许多“金属及其化合物”的知识规律可以通过金属活动性顺序来掌握。例如,工业上冶炼金属,根据金属活动性顺序可以采用不同的冶炼方法。其中可以用“热分解法”冶炼的金属是__________、 。
工业上又常用下列反应进行金属钾的冶炼: ,似乎“违背”了金属活动性顺序,试解释钠能将更活泼的钾置换出来的原因_____________
__ 。
,似乎“违背”了金属活动性顺序,试解释钠能将更活泼的钾置换出来的原因_____________
__ 。
⑵在实践中发现还有许多化学事实 “违背”金属活动性顺序,但这些“反常”现象都可以通过化学原理得到合理解释。某学生在做探究实验时,把锌粒投入1mol·L-1氯化铁溶液中,观察到如下实验现象:锌粒表面有一定量气泡产生,溶液颜色逐渐变浅,一段时间后溶液逐渐浑浊,试用相关反应方程式进行解释__________________________________、
___________________________________________________________________________。
⑶研究金属活动性顺序还可以指导对金属阳离子氧化性强弱的认识,工业上用氯化铁溶液腐蚀铜制电路板。
①请根据金属活动性顺序结合该反应原理,比较Cu2+、Fe3+、Fe2+的氧化性强弱 。
②请运用原电池原理设计实验验证Cu2+、Fe3+氧化性强弱的结论。
方案:______________________________________________________________________。
14.某兴趣小组为探究温度、压强对可逆反应A(g)+B(g)  C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10L的密闭容器中充入1molA和1molB,反应达平衡时测得容器中各物质的浓度为[浓度1]。然后改变外界条件又做了两组实验:①只升高温度;②只改变体系压强;分别测得新平衡时容器中各成分的浓度为[浓度2]、[浓度3]。
C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10L的密闭容器中充入1molA和1molB,反应达平衡时测得容器中各物质的浓度为[浓度1]。然后改变外界条件又做了两组实验:①只升高温度;②只改变体系压强;分别测得新平衡时容器中各成分的浓度为[浓度2]、[浓度3]。
|
|
A |
B |
C |
|
浓度1 |
0.05mol·L-1 |
amol·L-1 |
0.05mol·L-1 |
|
浓度2 |
0.078mol·L-1 |
0.078mol·L-1 |
0.122mol·L-1 |
|
浓度3 |
0.06mol·L-1 |
0.06mol·L-1 |
0.04mol·L-1 |
|
浓度4 |
0.07mol·L-1 |
0.07mol·L-1 |
0.098mol·L-1 |
请找出实验操作①②与实验数据[浓度2]、[浓度3]的对应关系,并分析下列结论,其中错误的是
A.由[浓度3]与[浓度1]的比较,可判断出正反应是放热反应
B.由[浓度2]与[浓度1]的比较,可判断平衡移动的原因是升高温度
C.[浓度1]中a=0.05mol·L-1
D.该组某学生在实验①过程中,测得各物质在某一时刻的浓度为[浓度4]。与[浓度1]
比较,可发现该同学在测定[浓度4]这组数据时出现了很大的误差。
第Ⅱ卷(非选择题 共 72 分)
13.下列有关描述错误的是
A.铝既能与盐酸反应,又能与氢氧化钠溶液反应,说明铝既有氧化性又有还原性
B.在所有氧化还原反应中,氧化剂的氧化性一定大于氧化产物的氧化性
C.催化剂只能改变化学反应速率,不能改变化学反应进行的限度
D.一定条件下的可逆反应,反应物的转化率不可能达到100%
12.下列有关溶液中各种离子浓度的关系错误的是
A.0.1mol·L-1NH4Cl溶液中:c(Cl-)+ c(OH-) =c(NH4+)+c(H+)
B.0.1mol·L-1NaHSO3溶液中:c(SO32-)+c(HSO3-)+c(H2SO3)=0.1mol·L-1
C.0.1mol·L-1KAl(SO4)2溶液中:c(SO42-)=c(Al3+)+c(K+)
D.足量铁屑溶于稀硝酸所得溶液中:c(NO3-)>c(Fe2+)>c(H+)>c(OH-)
11.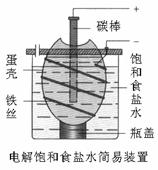 右图为电解饱和食盐水的简易装置,下列有关说法正确
右图为电解饱和食盐水的简易装置,下列有关说法正确
的是
A.电解一段时间后,往蛋壳中溶液中滴加几滴酚酞,呈红色
B.蛋壳表面缠绕铁丝发生氧化反应
C.铁丝表面生成的气体能使湿润的淀粉碘化钾试纸变蓝
D.蛋壳可阻止生成的氯气与氢气、氢氧化钠溶液接触
10. 神经系统专家研究发现,多巴胺在神经系统中传递信息,能使人处于愉悦状态,多巴胺的结构如右图所示,下列有关多巴胺的叙述正确的是
神经系统专家研究发现,多巴胺在神经系统中传递信息,能使人处于愉悦状态,多巴胺的结构如右图所示,下列有关多巴胺的叙述正确的是
A.多巴胺能和溴水发生加成反应
B.多巴胺分子既能和盐酸反应,又可与烧碱反应
C.多巴胺分子中所有碳原子一定共平面
D.多巴胺的分子式为C8H12O2N
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com