
题目列表(包括答案和解析)
26.(12分)现有六种元素A、B、C、D、E均为周期表中前18号元素,且原子序数依次增大。已知A和B是形成化合物种类最多的两种元素;B元素和C元素通常形成电子数为14或22的化合物。D元素的原子半径是短周期主族元素中最大的;E元素是地壳中含量最高的金属。请回答以下问题:
(1)请画出D的离子结构示意图 ;由C、A两种元素形成的18电子化合物的电子式为 ;
(2)E的最高价氧化物与D的最高价氧化物的水化物反应的离子方程式: ;
(3)由以上五种元素两两组合所形成的化合物中,既含有离子键又含有非极性共价键的常见化合物有 (填化学式);它的主要用途是 ,它与水反应的离子方程式 。
25.(14分)离子反应是中学化学中重要的反应类型,回答下列问题:
(1)在发生离子反应的反应物或生成物中,一定存在有 (填编号)。
①单质 ②氧化物 ③电解质 ④盐 ⑤化合物
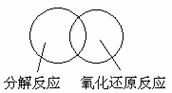 (2)可用图示的方法表示不同反应类型之间的关系。如分解反应和氧化还原反应可表示为下图。请在下面的方框中画出离子反应、置换反应和氧化还原反应三者之间的关系。
(2)可用图示的方法表示不同反应类型之间的关系。如分解反应和氧化还原反应可表示为下图。请在下面的方框中画出离子反应、置换反应和氧化还原反应三者之间的关系。
(3)有一瓶澄清的溶液,其中可能含有H+、NH+4、Mg2+、Ba2+、Al3+、I-、NO-3、CO2-3、SO2-4、AlO-2,取该溶液进行以下实验:
①取pH试纸检验,表明溶液呈强酸性。排除_________离子存在。
②取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡后CCl4呈紫红色,可以排除 存在。
③另取部分溶液逐渐加入NaOH溶液,使溶液从酸性逐渐变为碱性,在反应过程中均无沉淀产生,则可排除_________的存在。
④取部分上述碱性溶液加Na2CO3溶液,有白色沉淀生成,证明______存在,又排除________存在。
⑤根据上述实验事实还不能确定是否存在的离子是____ ____;
24.(6分)某一反应体系有反应物和生成物共五种物质:O2、H2CrO、Cr(OH)3、H2O、H2O2已知该反应中H2O2只发生如下过程:H2O2→O2
(1)该反应中的还原剂是 。
(2)写出该反应的化学方程式(可以不配平) 。
(3)如反应转移了0.3mol电子,则产生的气体在标准状况下体积为 L。
23.(18分)
(I)(4分)下列有关实验的叙述中,合理的是 (填序号)
A.把SO2通入紫色石蕊试液,可验证SO2的漂白性
B.一学生用pH试纸测得某氯水的pH为2
C.不宜用瓷坩埚灼烧氢氧化钠或碳酸钠
D.将10g ZnSO4·7H2O溶解在90g水中配制10%的ZnSO4溶液
E.向某溶液中滴加氯化钡溶液,产生不溶于稀硝酸的白色沉淀,则该溶液中一定
含有SO2-4
F.配制一定物质的量浓度的溶液,定容时俯视容量瓶的刻度线,会使所配溶液浓度偏高
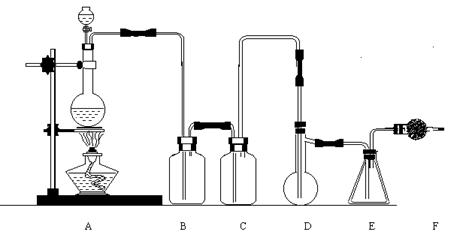 (II)(14分)二氯化硫(SCl2)熔点-78℃,沸点59℃。密度1.638g/mL。遇水易分解二氯化硫与三氧化硫作用可生成重要化工试剂亚硫酰氯(SOCl2)。以下是由氯气与硫反应合成二氯化硫的实验装置。
(II)(14分)二氯化硫(SCl2)熔点-78℃,沸点59℃。密度1.638g/mL。遇水易分解二氯化硫与三氧化硫作用可生成重要化工试剂亚硫酰氯(SOCl2)。以下是由氯气与硫反应合成二氯化硫的实验装置。
回答下列问题:
(1)装置B盛放的药品是 C中是
(2)实验开始前先在D中放入一定量的硫粉,加热使硫熔化,然后转动和摇动烧瓶使硫附着在烧瓶内壁表面形成一薄层,这样做的目的是
(3)实验时,D装置需加热至50-59℃,最好采用何种方式加热 。为了防止E中液体挥发,可以采取的措施 。
(4)F装置中干燥管内所盛物质是 的作用是:
22.将氯化铝溶液和氢氧化钡溶液等体积混合,得到的沉淀物中含铝元素的质量与溶液中铝元素的质量相等,则原氮化铝溶液和氢氧化钡溶液的物质的量浓度之比可能是( )
A.1:3 B.2:3 C.1:4 D.4:3
第Ⅱ卷(共5分)
22.4L
C.0.1 mol金属钠与氧气在一定条件下发生反应,生成氧化钠和过氧化钠的混合物时,失去的电子数不一定为0.1NA
D.1L 1mol·L-1硫酸铁溶液中含有Fe3+离子数目为0.2N0
21.用NA表示阿伏加德罗常数的值,下列说法正确的是 ( )
A.46gNO2和N2O混合气体中含有的原子总数为3NA
B.用含4mol HCl的浓盐酸跟足量二氧化锰反应,生成的氯气在标准状况下的体积为
20.在下述条件下,一定能大量共存的离子组是 ( )
A.无色透明的水溶液中:K+、Ba2+、I-、MnO-4
B.含有大量NO-3的水溶液中:NH+4、Fe2+、SO2-4、H+
C.c(HCO-3)=0.1MOL·L-1的溶液中:Na+、K+、CO2-3、Br-
D.强碱性溶液中:ClO-、S2-、SO2-3、Na+
19.下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是 ( )
①①向饱和碳酸钠溶液中通入过量的CO2;
②向Fe(OH)3胶体中逐滴加入过量的稀盐酸;
③向AgNO3溶液中逐滴加入过量氨水;
④向硅酸钠溶液中逐滴加入过量的盐酸
A.①② B.①④ C.①③ D.②③
18.某集气瓶内装的混合气体呈红棕色,加入足量蒸馏水,盖上玻璃片振荡得橙黄色溶液,气体颜色消失,再打开玻璃片后,瓶中气体又变为红棕色,该混合气体可能是( )
A.N2、NO2、Br2 B.NO2、NO、N2
C.NO2、NO、O2 D.N2、O2、Br2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com