
题目列表(包括答案和解析)
11.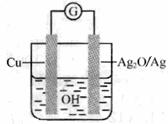 普通水泥在固化过程中自由水分子减少并形成碱性溶液。根据这一物理化学特点,科学家发明了电动势法测水泥的初凝时间。此法的原理如图所示,反应的总方程式为:
普通水泥在固化过程中自由水分子减少并形成碱性溶液。根据这一物理化学特点,科学家发明了电动势法测水泥的初凝时间。此法的原理如图所示,反应的总方程式为:
2Cu+ Ag2O= Cu2O 十2Ag下列有关说法正确的是
A. 工业上以黏土、石灰石和石英为主要原料来制造普通水泥
B. 负极的电极反应式为 Cu十 2OH- -2e-==Cu2O + H2O
C. 测量原理示意图中,电流方向从 Cu 经过导线流向 Ag2O
D. 电池工作时,溶液中 OH-向正极移动
10.一定温度下可逆反应:A(s)+2B(g) C(g)+D(g) △H<0。现将1mol A和2molB加入甲容器中,将2
molC和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图所示,隔板K不能移动)。下列说法正确的是
C(g)+D(g) △H<0。现将1mol A和2molB加入甲容器中,将2
molC和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图所示,隔板K不能移动)。下列说法正确的是
A.保持温度和活塞位置不变,甲中再加入1 mol A和2molB,达到新的平衡后,c(B)甲=c(B)乙
B.保持温度和乙中压强不变 ,向乙中加入2 mol D,达到新平衡 后,c(B) 乙≤2c(B) 甲
C.若该温度下反应的K=1,则甲中B和乙中C的转化率均为66.7%
D.保持活塞位置不变,升高温度,达到新的平衡后甲、乙中B的体积分数均增大

|
|
 P
P
9.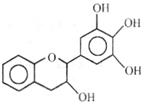 “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂。其中没食子儿茶素( EGC
)的结构如图所示。关于 EGC
的下列叙述中不正确的是
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂。其中没食子儿茶素( EGC
)的结构如图所示。关于 EGC
的下列叙述中不正确的是
A.能发生加成反应、氧化反应和取代反应
B . 遇 FeC13 溶液能发生显色反应
C. 分子中所有的原子可能共平面
D. l mol EGC 与 4 mo1NaOH 恰好完全反应
8.25℃时,下列各溶液中有关物质的量浓度关系正确的是
A.pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:
c(Na+) >c(CH3COO-)>c(H+)>c(OH-)
B.常温下将等体积等物质的量浓度的醋酸钠与盐酸两溶液混合:
c(Na+) > c(CH3COOH) >c(CH3COO-)>c(H+)>c(OH-)
C.向NH4HSO4溶液中滴加等物质的量的NaOH:
c(Na+) =c(SO42-) >c(NH4+) >c(H+) >c(OH-)
D.pH相同的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液、NaOH溶液:
c(CH3COONa)>c(Na2CO3) >c(C6H5ONa ) >c(NaOH )
7.下列离子方程式正确的是
A.Fe(OH)3与氢溴酸溶液混合:Fe(OH)3+3H+=Fe3++3H2O
B.1mol/L的NaAlO2溶液和2.5 mol/L的HCl等体积互相均匀混合:
2AlO2-+5H+ =Al(OH)3↓+Al3++H2O
C.向硫酸铝铵[NH4Al(SO4)2]溶液中滴加少量Ba(OH)2溶液
NH4++Al3++2SO42-+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3·H2O+2H2O
D.碳酸氢镁溶液中加入足量氢氧化钠:
Mg2+ + 2HCO3ˉ+ 2OHˉ= MgCO3↓+ 2H2O + CO32-
6.下列各组溶液中,可能大量共存的离子有
A.含有大量 Ba2+的溶液中: HCO3-、 Ag+、 Fe3+、 Cl-
B.滴加甲基橙试液后呈红色的溶液中: Na+、 CO32-、 K+、 AlO2-
C.由水电离的 c (OH- ) = 10-14mol·L-1的溶液中: CH3COO-、 C6H5O-、 Na+、 K+
D.加入铝粉后产生氢气的溶液中: NH4 +、 Na+、 NO3- 、 OH-
不定项选择题 ( 本题包括6小题,每小题4分,共计24分。每小题有一个或二个选项符合题意。若正确答案只包括一个选项,多选时,该题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分)
5. 原子的核电荷数小于18的某元素X,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数为2n2-1.下列有关X的说法中不正确的是
A.X最高价氧化物对应的水化物可能显碱性
B.X可能形成化学式为KXO2的钾盐
C.X原子的最外层电子数和核电荷数肯定为奇数
D.X能与某些金属元素形成离子化合物
2.具备基本的化学实验技能是进行科学探究的基础和保证。下列有关实验操作正确的是
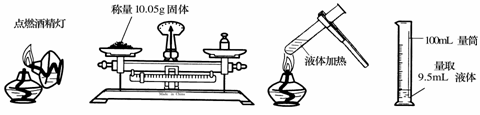
A B C D
3设NA为阿伏加德罗常数的值,下列叙述中正确的是
A.标准状况下,5.6L甲醇完全燃烧生成CO2分子数为0.25NA
B.pH=13 的氢氧化钠溶液中所含 Na+数约为0 .1 NA
C . 5 . 6g铁丝在足量的氧气中燃烧时失去电子数为 0 . 3NA
D . 14g乙烯和丙烯的混合气体中所含原子总数为 3 NA
4下列化学实验或操作能够达到目的的是
A 不加热的情况下,可以用铜片鉴别稀硝酸、稀硫酸和稀盐酸
B 乙酸乙酯中混有乙酸,可选用稀的 NaOH 溶液洗涤,然后将两层液体分开
C 将 10 gCuSO4·5H2O 溶解在 90g水中可以配制成质量分数为 10 %的 CuSO4溶液
D 淀粉在酸性条件下水解后,加入过量氢氧化钠溶液,再滴加几滴硫酸铜溶液,加热可以检验生成的葡萄糖
1.生产、生活离不开各种化学物质,下列说法不正确的是
A 人造纤维、合成纤维和光导纤维都是有机高分子化合物
B 不需要通过化学反应就能从海水中获得食盐和淡水
C 加热能杀死甲型 HINI 流感病毒是因为病毒的蛋白质受热变性
D 氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂设
20.(10分)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应反应N2(g)+3H2(g) 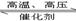 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡
(填“向左”“向右”或“不”)移动;使用催化剂 (填“增大”“减小”或“不改变”)反应的ΔH.
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡
(填“向左”“向右”或“不”)移动;使用催化剂 (填“增大”“减小”或“不改变”)反应的ΔH.
(2)已知:O2 (g) = O+2(g)
+ e-
 H1= 1175.7 kJ·mol-1
H1= 1175.7 kJ·mol-1
PtF6(g) + e- = PtF6-(g)
 H2= - 771.1 kJ·mol-1
H2= - 771.1 kJ·mol-1
O2+ PtF6-(s) = O2+(g)
+ PtF6-  H3=482.2 kJ·mol-1
H3=482.2 kJ·mol-1
则反应O2(g)+ PtF6
(g) = O2+PtF6- (s)  H=_____________ kJ·mol-1。
H=_____________ kJ·mol-1。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成_______________沉淀(填化学式),生成该沉淀的离子方程式为___________________________________________________________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com