
题目列表(包括答案和解析)
6. (1)2003年底,重庆发生井喷毒气伤人事件,这主要是混杂在天然气中的硫化氢(化学式 )、HCN等有毒气体使人中毒。
(2)硫和氧都是 族的元素,乙醇可以看成是水中一个H被乙基替代的衍生物,因此硫化氢中的一个H也可以被乙基替代,得到乙硫醇,其化学式为 。
(3)根据上述规律,异丙硫醇、苯硫酚的化学式分别是 和 。
(4)类似地,如果丙酮中的O被S替代,得到CH3-CS-CH3,则其命名为 ;同样,已知CH3-CO-SH命名为乙硫羟酸,则CH3-CS-OH可命名为 。
(5)苯硫酚具有比苯酚还强的酸性,则对硝基苯硫酚与氢氧化钾反应的化学方程式为:
(6)硫醇也具有一定的酸性,可以与碱反应,1mol HSCH2CH(NH2)COOH能与 mol的NaOH反应。
5. 与醛基相邻的碳原子上的氢原子叫a-H,无a-H的醛在强碱作用下,发生分子间氧化-还原反应生成酸和醇,叫做康尼查罗反应,例如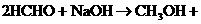
 ,则下列化合物中不发生康尼查罗反应的是( )
,则下列化合物中不发生康尼查罗反应的是( )
①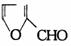 ②
②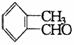 ③
③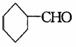 ④
④
A.①② B.①②④ C.③④ D.①②③④
4.(多选)在烃分子中去掉2个氢原子形成一个双键是吸热反应,大约需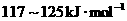 .的热量,但1,3-环己二烯失去2个氢原子变成苯是放热反应,反应热
.的热量,但1,3-环己二烯失去2个氢原子变成苯是放热反应,反应热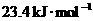 ,以上事实表明( )
,以上事实表明( )
A.1,3-环己二烯加氢是吸热反应 B.1,3-环己二烯比苯稳定
C.苯加氢生成环己烷是放热反应 D.苯比1,3-环己二烯稳定
3. 有机物(1) (2)
(2)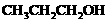 (3)
(3)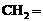
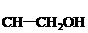 (4)
(4)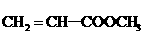 (5)
(5)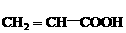 中,既能发生加成反应、酯化反应,又能发生氧化反应的是( )
中,既能发生加成反应、酯化反应,又能发生氧化反应的是( )
A.(3)(5) B.(1)(3)(5) C.(2)(4) D.(1)(3)
2.(多选)将阿司匹林放入足量的NaOH溶液中煮沸,能发生反应的化学键是( )
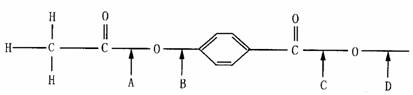
1.(多选) 下列物质中,不能与小苏打反应的是( )
A.甲酸 B.乙酸 C.碳酸 D.苯酚
2.能根据结构推导有机物的性质,能根据有机物的性质推导可能的结构。
[典型例题]
[例题1]在下列反应式中的括号里填上恰当的反应物
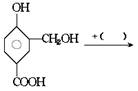
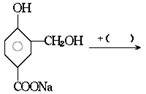
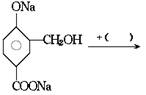
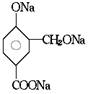
[例题2]吗丁啉是一种常见的胃药,其有效成分的结构简式可用下图表示。关于该物质的下列说法不正确的是( )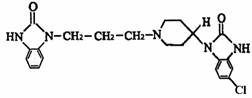
A、该物质的分子式为C22H25ClN5O2 B、该物质具有碱性,能与酸反应
C、该物质能发生水解反应 D、该物质能发生取代反应和加成反应
[课堂练习]
1.掌握常见的有机官能团的结构及性质。
 21A.(物质结构与性质)A、B、C、D、E、F是元素周期表前四周期的元素,它们在元素周期中的位置如下图所示:
21A.(物质结构与性质)A、B、C、D、E、F是元素周期表前四周期的元素,它们在元素周期中的位置如下图所示:
⑴写出F的基态原子核外电子排布式:__________________。
⑵C元素的第一电离能比同周期相邻的两种元素的第一电离能都高的原因是_________
___________________________________。
 ⑶由A、B、D三种元素形成的一种物质俗称光气,分子中A
⑶由A、B、D三种元素形成的一种物质俗称光气,分子中A
原子采取sp2杂化成键。光气分子的结构式是___________,其中
碳氧原子之间共价键是_____(填序号):
a.2个σ键 b.2个π键 c.1个σ键、1个π键
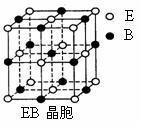
⑷EB晶胞如右图所示,EB晶体中E2+的配位数为_____,EB晶体
和NaCl晶体中离子排列方式相同,其晶格能分别为:
EB-3401kJ/mol、NaCl-786kJ/mol。导致两者晶格能差异的主要
原因是_______________________________________________。
⑸现有含F的两种颜色的晶体,一种为紫色,另一为绿色,它们都是配位数为6的配合物(配离子难电离)。相关实验证明,两种晶体的组成皆为FD3·6H2O。为测定这两种晶体的化学式,取等质量的两种晶体分别配成待测溶液,各滴入足量的AgNO3(aq),原绿色晶体的水溶液得到白色沉淀的质量为紫色晶体的水溶液得到白色沉淀质量的2/3 。
则紫色晶体配合物的化学式为________________,绿色晶体中含有化学键类型是
。
21B.(实验化学)“百年新药”阿司匹林自问世以来,一直作为解热镇痛药用于头痛、发热、神经痛、风湿热等疾病的治疗,20世纪70年代以后阿司匹林在其它领域的防治功能被逐步开发,如阿司匹林可增进大脑血液循环,对冠心病有预防作用。
药品“阿司匹林泡腾片”说明书上标明:阿司匹林的有效成分是乙酰水杨酸,结构简式为: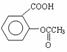 ,每片含乙酰水杨酸0.3g。
,每片含乙酰水杨酸0.3g。
某研究性学习小组看了市售阿司匹林的药品说明书,为了验证乙酰水杨酸的官能团和测定市售阿司匹林的有效成分含量,进行了下列实验探究:
⑴阿司匹林有效成分中羧基和酯基官能团的验证
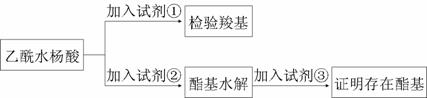
试剂①是________,现象为_________;
该方案通过检验乙酰水杨酸水解生成的____________,并通过分析间接验证酯基的存在。
⑵市售阿司匹林的有效成分含量的测定
用酸碱滴定法测定市售阿司匹林有效成分的真实含量,实验步骤如下:
①取6片市售阿司匹林药片放入锥形瓶中,再加入1.500mol·L-1的氢氧化钠溶液,为确保阿司匹林和氢氧化钠溶液充分反应,加入1.500mol·L-1的氢氧化钠溶液的体积应大于_____mL。
②将反应后的溶液冷却,加入几滴________,用0.5000mol·L-1的标准盐酸滴定过量的氢氧化钠,至____________________________________。
③重复步骤①和步骤②
问题讨论:
为什么不用氢氧化钠溶液直接滴定乙酰水杨酸_________________________________。
为什么要进行两次滴定?___________________________________________。
20.为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
⑴实验测得,1 g甲醇在氧气中充分燃烧生成二氧化碳和液态水释放出22.7kJ的热量,试写出甲醇燃烧的热化学方程式。
⑵由气态基态原子形成 1mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
已知,CH3-CH3→CH2=CH2+H2;有关化学键的键能如下。 化学键 C-H C=C C-C H-H 键能(kJ/mol) 414.4 615.3 347.4 435.3
试计算该反应的反应热(在答题纸中写出计算过程)。
⑶依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行理论推算。
 试依据下列热化学方程式,计算反应2C(s)+2H2(g)+O2(g) CH3COOH(l)的焓变(在答题纸中写出计算过程)。
试依据下列热化学方程式,计算反应2C(s)+2H2(g)+O2(g) CH3COOH(l)的焓变(在答题纸中写出计算过程)。
 ①CH3COOH(l)+2O2(g) 2CO2(g)+2H2O(l);△H1=-870.3kJ·mol-1
①CH3COOH(l)+2O2(g) 2CO2(g)+2H2O(l);△H1=-870.3kJ·mol-1
 ②C(s)+O2(g) CO2(g);△H2=-393.5kJ·mol-1
②C(s)+O2(g) CO2(g);△H2=-393.5kJ·mol-1
 ③H2(g)+1/2O2(g) H2O(l);△H3=-285.8kJ·mol-1
③H2(g)+1/2O2(g) H2O(l);△H3=-285.8kJ·mol-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com