
题目列表(包括答案和解析)
16、铝镁合金已成为轮船制造、化工生产等行业的重要材料。研究性学习小组的三位同学,为测定某含镁3%一5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列三种不同实验方案进行探究。填写下列空白。
[探究一]实验方案:铝镁合金 测定剩余固体质量
实验中发生反应的化学方程式是
实验步骤:1)称取5.4g铝镁合金粉末样品,投入VmL 2.0mol·L-1NaOH溶液中,充分反应。
NaOH溶液的体积V≥
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将 (“偏高”或“偏低”)

 [探究二]
[探究二]
实验方案:铝镁合金 测定生成气体的体积,实验装置如右图,
问题讨论:
(1)某同学提出该实验装置不够完善,应在A、B之间
添加一个干燥、除酸雾的装置。你的意见是: (填“需要”或“不需要”)。
(2)为使测定结果尽可能精确,实验中应注意的问题是(写出两点):
① ②
 [探究三]
[探究三]
实验方案:称量x g铝镁合金粉末.放在如右图所示装置的惰性电热
板上,通电使其充分灼烧。
问题讨论: (1)欲计算Mg的质量分数,
该实验中还需测定的数据是
(2)若用空气代替O2进行实验,对测定结果是否有影响? (填“是”或“否”)。
[实验拓展] 参照探究一、探究二实验方案,请你另设计一个实验方案,测定该铝镁合金中镁的质量分数。(书写形式可以模仿探究一、二)
15、A、B、C、D分别代表四种不同的短期周期元素。A元素的原子最外层电子排布为ns1,B元素的原子价电子排布为ns2np2,C元素原子的最外层电子数是其电子层数的3倍,D元素原子的M电子层的P轨道中有3个电子。 (1)C原子的电子排布式为 ,若A元素的原子最外层电子排布为1s1,则按原子轨道的重迭方式,A与C形成的化合物中的共价键属于 键。
(2)当n=2时,B与C形成的晶体属于 晶体。当n=3时,B与C形成的晶体中微粒间的作用力是 。 (3)若A元素的原子最外层电子排布为2s1,B元素的原子价电子排布为3s23p2,元素A在周期表中的位置是 ,A、B、C、D四种元素的第一电离能由大到小的顺序是 (用元素符号表示)
14、某溶液中只含有Na+、H+、OH-、A-四种离子,下列说法正确的是
A.若溶液中c(A-)== c(Na+),则溶液一定呈中性
B.溶液中不可能存在:c(Na+)>c (A-)>c(OH-)>c(H+)
C.若c(OH-)>c(H+),溶液中不可能存在:c(Na+)>c(OH-)>c(A-)>c(H+)
D.若溶质为NaA、HA,则一定存在: c(A-)>c(Na+)>c(H+)>c(OH-)
13、对于达到平衡的可逆反应:X+Y  W+Z,增大压强,则正、逆反应速率(
W+Z,增大压强,则正、逆反应速率( )变化的图象如右图所示,关于X、Y、Z、W物质的聚集状态的说法可能正确的是
)变化的图象如右图所示,关于X、Y、Z、W物质的聚集状态的说法可能正确的是
 A.Z、W均匀为气体,X、Y有一种是气体
A.Z、W均匀为气体,X、Y有一种是气体
B.Z、W中有一种是气体,X、Y皆为非气体
C.X、Y、Z皆为气体,W为非气体
D.X、Y均为气体,W、Z中有一种是气体
12、右图是一套实验室制气装置,用于发生、干燥、收集和吸收有毒气体。下列各组物质能利用这套装置进行实验的是
A.电石和水 B.MnO2和浓盐酸
C.Cu片和浓硝酸 D.Na2SO3(s)和浓硫酸
11、从中药材中提取的金丝桃素对人工感染的H5N1亚型禽流感家禽活体具有良好的治愈率。已知金丝桃素的结构简式如右图所示,下列有关说法正确的是 ( )
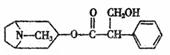 A.金丝桃素的分子式煤C17H23O5N
A.金丝桃素的分子式煤C17H23O5N
B.1mol金丝桃素最多能与4molH2发生加成反应
 C.金丝桃素能与浓硫酸和浓硝酸的混合液反应
C.金丝桃素能与浓硫酸和浓硝酸的混合液反应
D.金丝桃素在NaOH溶液中加热反应得到的两种芳香族化合物
10、我国成功地发射了嫦娥一号探测卫星,确定对月球土壤中14种元素的分布及含量进行探测等。月球的矿产资源极为丰富,仅月球表面5cm厚的沙土就含铁单质有上亿吨,月球上的主要矿物有辉石[CaMgSi2O6]、斜长石[KAlSi3O8]和橄榄石[(MgFe)2SiO4]等,下列说法或分析不正确的是
A.辉石、斜长石及橄榄石均属于硅酸盐矿B.斜长石的氧化物形式可表示为:K2O·Al2O3·6SiO2
C.橄榄石中铁为+2价 D.月球上有游离态铁是因为月球上铁的活动性比地球上铁的活动性弱
9、下列各组离子,在指定的环境中一定能大量共存的是
A.澄清透明的无色溶液中:Cl-、MnO4-、Ag+、SO42-B.在能使pH试纸变深蓝色的溶液中:Na+、NO3-、S2-、CO32-
C.加入铝粉产生H2的溶液中:NH4+、K+、SO42-、NO3-D.由水电离出的c(OH-)=10-13 mol·L-1溶液中:Na+、Ba2+、Cl-、I-
8、有一不饱和的NaOH溶液。加入a mol Na2O、b mol Na2O2或c mol NaOH恰好得到NaOH饱和溶液(同一温度下).则a、b、c的关系为 ( ) A.a=b=c/2 B.a=b>c/2 C.a=b<c/2 D.a>b>c
7、A、B是短周期中的2种元素,其最外层电子数之和为7,其中B的最外层电子数是最内层电子数的3倍。下列叙述中不正确的是
A.若A、B同周期,A的金属性比B的金属性强B.A元素是同周期中除稀有气体外的原子半径最大的元素
C.A、B两元素形成的化合物形式有A2B或A2B2,均为离子化合物D.B元素的单质固态时均为分子晶体
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com