
题目列表(包括答案和解析)
6、下列各组离子在溶液中能大量共存,加入Fe2(SO4)3后仍能大量共存的是
A. Na+、I-、CO32-、ClO-
B. Fe2+、H+、K+、NO3-
C. Ba2+、Na+、SCN-、Cl-
D. Cu2+、Mg2+、Cl-、NO3-
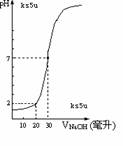
5、右图为10mL一定物质的量浓度的盐酸X,用一定物质的量浓度的NaOH
溶液Y滴定的图示,据图推出NaOH溶液和盐酸的物质的量的浓度是( )
|
|
A |
B |
C |
D |
|
C(HCl)(mol/L) |
0.12 |
0.04 |
0.18 |
0.09 |
|
C(NaOH)(mol/L) |
0.04 |
0.12 |
0.06 |
0.03 |
4、在雷达的微波过滤器里使用的铁氧磁性体,如钇铁石榴石Y3Fe5O12,其中Y是ⅢB族稀土元素。下面有关钇铁石榴石的叙述中正确的是( )
A .可表示为3YO3·3FeO·Fe2O3
B.可表示为Y3O5·Fe3O4·Fe2O3
C. 其中钇、铁的化合价均为+3价
D.其中钇、铁的化合价均有+2、+3价
3、已知:1mol 肼(N2H4)(g)与NO2在一定条件下,完全反应生成N2(g)和水蒸气放出567.85 kJ的热量。下列关于肼和NO2反应的热化学方程式中,正确的是:
A.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(l);△H = – 1135.7 kJ/mol
B.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(g);△H = +1135.7kJ/mol
 C.N2H4+ NO2 =
3/2N2+ 2H2O ;△H = –567.85kJ/mol
C.N2H4+ NO2 =
3/2N2+ 2H2O ;△H = –567.85kJ/mol
D.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(g);△H = – 1135.7 kJ/mol
2、中学化学教材中有大量数据,下列为某同学对数据的利用情况,其中不正确的是( )
A. 用NaOH和HCl 反应测得的中和热,推算一定量稀H2SO4和NaOH 溶液反应的反应热
B. 用沸点数据推测两种液体混合物用蒸馏方法分离开来的可能性
C. 用沸点数据来分析分子的稳定性
D. 用原子(或离子)半径数据推断某些原子(或离子)氧化性或还原性强弱
1、生活中碰到的某些问题,常涉及到化学知识,下列分析不正确的是
A.Mg(OH)2和Al(OH)3热分解生成的气态水可覆盖火焰、驱逐O2、稀释可燃气体,分解产物MgO和Al2O3能较快地与塑料燃烧过程中产生的酸性及腐蚀性气体反应,所以它们可以作为未来发展方向的无机阻燃剂。
B.用灼烧并闻气味的方法区别纯棉织物和纯毛织物。
C.某雨水样品采集后放置一段时间,pH值由4.68变为4.28,是因为水中溶解了较多的CO2。
D.蒙古牧民喜欢用银器盛放鲜牛奶有其科学道理:用银器盛放鲜牛奶,溶入的极微量的银离子,可杀死牛奶中的细菌,防止牛奶变质。
16、在化工试剂生产中,要除去某种杂质离子,往往采用一定条件下使之生成MXAy(DE4)Z(OH)12浅黄色复盐晶体析出。化学式中OH为氢氧根,而M、A、D、E代表四种未知元素。已知⑴X+Y+Z=12(x、Y、Z为正整数)。⑵取9.7g该化合物溶于含有稀硝酸的水中,滴加硝酸钡溶液,使D、E元素完全转变为白色沉淀,过滤干燥后称量为9.32g。⑶滤液中A、M以阳离子形式存在,用胶头滴管滴滤液2-3滴在白色点滴板(或玻璃片)上,再滴加1-2滴硫氰化钾溶液,溶液呈血红色。⑷往滤液中通入足量的硫化氢气体,使A离子全部被还原后,产生黄色沉淀物,过滤干燥后,称量为0.96g。⑸化合物中A元素的百分含量为34.64%。试通过计算推理判断:
⑴ 确定D和E: 、 (写元素符号)。
⑵ 确定x、y、z和A: x==_________、y==___________、z==_________、A是____________________。
⑶ M代表的元素是______________;化合物的化学式为____________________。
15、元素的电离能对元素的性质影响很大。
(1)观察下表总结三条有关第一电离能变化的规律
例如:同周期主族元素的第一电离能的变化趋势是由小变大;
;
;
。
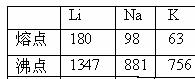 (2)根据这三个图表回答:(M表示碱金属)
(2)根据这三个图表回答:(M表示碱金属)
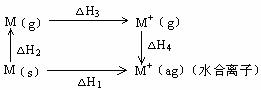
△H2(Li) △H2(Na), △H3(Li) △H3(Na),已知金属锂比钠活泼,则△H4(Li) △H4(Na)。
(3)钒(V)原子的基态电子排布式为: ,钒元素的最高化合价为 。
(4)CuO受热易分解为Cu2O和O2,请从铜的原子结构来说明CuO受热易分解的原因:
。
14. 在密闭容器中有可逆反应:nA(g)+mB(g)
pC(g)
△H>0处于平衡状态,(已知m+n>p),则下列说法正确的是
在密闭容器中有可逆反应:nA(g)+mB(g)
pC(g)
△H>0处于平衡状态,(已知m+n>p),则下列说法正确的是
①升温,c(B)/c(C)的比值变小②降温时体系内混合气体平均分子量变小③加入B,A的转化率增大 ④加入催化剂,气体总的物质的量不变⑤加压使容器体积减小,A或B的浓度一定降低⑥若A的反应速率为VA,则B的反应速率为n·VA /m
 A.①②③⑤ B.①②③④ C.①②⑤⑥ D.③④⑤⑥
A.①②③⑤ B.①②③④ C.①②⑤⑥ D.③④⑤⑥
0.1mol·L-1NaHA溶液的pH = 2。则下列说法不正确的是:
A.因为A2-+H2O  HA-+OH-,所以Na2A溶液显碱性
HA-+OH-,所以Na2A溶液显碱性
B.0.1mol·L-1 H2A溶液中氢离子的物质的量浓度为0.11 mol·L-1
C.NaHA溶液中各种离子浓度的关系是c(Na+ ) > c(HA-) > c(H+) > c(A2-) > c(OH- )
D.在NaHA溶液中,HA-电离的趋势大于其水解的趋势
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com