
题目列表(包括答案和解析)
12.下图两个装置中,液体体积均为200 mL,开始工作前电解质溶液的浓度均为0.5
mol/L,工作一段时间后,测得有0.02 mol电子通过,若忽略溶液体积变化,下列叙述正确的是 ( )
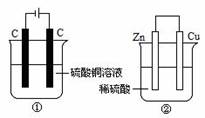 A.产生气体体积: ①=②
A.产生气体体积: ①=②
B.①中阴极质量增加,②中正极质量减小
C.电极反应式:①中阳极:4OH-→ 2H2O+O2↑- 4e-
②中负极:2H++2e-→H2↑
D.溶液的pH变化:①减小,②增大
11.在25℃下,将a mol·L-1的醋酸(HAc)与0.01 mol·L-1的氢氧化钠溶液等体积混合,反
应平衡时溶液中c(Na*)=c(Ac-)。则下列说法中,不正确的是 ( )
A.此时醋酸和氢氧化钠溶液恰好中和
B.反应平衡时溶液显中性
C.用含a的代数式表示醋酸(HAc)的电离常数为Ka= mol·L-1
D.a肯定大于0.01
10.取0.2 mol·L-1 HX溶液与0.2 mol·L-1 NaOH溶液等体积混合(忽略混合后溶液体
积的变化),测得混合溶液的pH=8,则下列说法(或关系式)正确的是 ( )
A.混合溶液中由水电离出的c(OH-)小于0.2 mol·L-1 HX溶液中由水电离出的c(H+)
B.c(Na+)=c(X-) +c(HX)=0.2 mol·L-1 k.s.5.u
C.c(Na+)-c(X-)=9.9×10-7 mol·L-1
D.c(OH-)=c(HX)+c(H+)=1×10-8 mol·L-1
9.在密闭容器中,反应X2(g)+Y2(g)
 2XY(g);ΔH<0,达到甲平衡。下面的三
2XY(g);ΔH<0,达到甲平衡。下面的三
个图形表示了在仅改变某一条件后,达到乙平衡的情况,对此过程的分析正确的是( )

A.图Ⅰ是加入适当催化剂的变化情况 B.图Ⅱ是扩大容器体积的变化情况
C.图Ⅲ是增大压强的变化情况 D.图Ⅲ是升高温度的变化情况
8.一定条件下,体积为5L的密闭容器中,0.5molX和0.5molY进行反应:2X(g)+Y(g)
 Z(g),经60s达到平衡,生成0.15molZ。下列说法正确的是( )
Z(g),经60s达到平衡,生成0.15molZ。下列说法正确的是( )
A.将容器体积变为10L,Z的平衡浓度变为原来的一半
B.以Y浓度变化表示的反应速率为0.0005mol·L-1·s-1 k.s.5.u
C.若增大压强,则物质Y的转化率减小
D.若降低温度,X的体积分数增大,则该反应的△H<0
7.“神舟七号”宇宙飞船的能量部分来自太阳能电池,另外内部还配有高效的MCFC型燃料
电池。该电池可同时供应电和水蒸气,所用燃料为氢气,电解质为熔融的碳酸钾。已知
该电池的总反应为2H2+O2 =2H2O,负极反应为H2 + CO32-→CO2↑ + H2O + 2e-,则下
列推断中,正确的是 ( )
A.电池工作时,CO32-向负极移动
B.电池放电时,外电路电子由通氧气的正极流向通氢气的负极k.s.5.u
C.正极的电极反应为:4OH-→O2↑+2H2O+2e-
D.通氧气的电极为阳极,发生氧化反应
6.某混合溶液中只含有两种溶质NaCl和CuSO4,且n(NaCl): n(CuSO4)=3:2。若以石
墨电极电解该溶液,下列推断中不正确的是 ( )
A.整个电解过程,最后电解的是水
B.阳极先析出Cl2,后析出O2
C.整个电解过程分三个阶段,第二阶段电解的是硫酸铜和水
D.阴极自始至终只析出铜
5.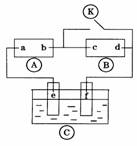 下图
下图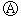 为直流电源,
为直流电源,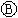 为浸透饱和氯化钠溶液和酚酞试液的
为浸透饱和氯化钠溶液和酚酞试液的
滤纸, 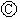 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现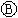 上的c点显红色.为
上的c点显红色.为
实现铁上镀锌,接通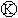 后,使c、d两点短路.下列叙述不正确
后,使c、d两点短路.下列叙述不正确
的是 ( )
A.b为直流电源的负极
B.f电极作为阴极,发生还原反应
C.f电极为锌板
D.e极发生氧化反应
4.25℃时,水的电离达到平衡:H2O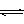 H++OH-;ΔH>0,下列叙述正确的是 ( )
H++OH-;ΔH>0,下列叙述正确的是 ( )
A.向水中加入稀氨水,平衡逆向移动,c(OH―)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热,Kw增大,pH不变
3.在已经处于化学平衡状态的体系中,如果下列量发生变化,其中一定能表明化学平衡移
动的是 ( )
A.反应混合物的浓度 B.反应体系的压强
C.正、逆反应的速率 D.反应物的转化率k.s.5.u
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com