
题目列表(包括答案和解析)
20.(6分)金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度(s,mol·L-1)见下图。
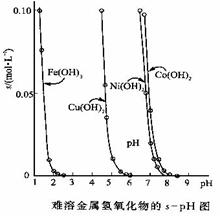
(1)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH为 (填序号)
① pH<1 ② pH=4左右 ③ pH>6
(2)在Ni(NO3)2溶液中含有少量的Co2+杂质, (填能或不能)通过调节溶液pH的方法来除去,
(3)已知一些难溶物的溶度积常数如下表。
|
物质 |
FeS |
MnS |
CuS |
PbS |
HgS |
ZnS |
|
Ksp |
6.3×10-18 |
2.5×10-13 |
1.3×10-36 |
3.4×10-28 |
6.4×10-53 |
1.6×10-24 |
某工业废水中含有Cu2+、Pb2+、Hg2+,最适宜向此工业废水中加入过量的___________除去它们。(选填序号)
①NaOH ②FeS ③Na2S
19.(8分)依据氧化还原反应:Cu2+(aq)+Fe(s) = Fe2+(aq)+Cu(s)
 设计的原电池如图所示。
设计的原电池如图所示。
请回答下列问题:
(1)电极X的材料是 ;电解质溶液Y是 ;
(2) X电极上发生的电极反应式为 。
(3)针对上述原电池装置,下列说法中,不正确的是 。
A.原电池工作时的总反应Cu2+(aq)+Fe(s) = Fe2+(aq)+Cu(s),一定为放热反应
B.原电池工作时,X电极流出电子,发生氧化反应
C.原电池工作时,银电极上发生氧化反应
D.原电池工作时,盐桥中的阳离子不断移向左池的氯化钠溶液中
(4)若Y为氯化钠溶液,则经过一段时间,发现X极上出现锈斑,则此过程中正极的电极反应式为
18.(11分)按要求回答下列各小题:
(1)将体积和物质的量浓度都相同的醋酸和氢氧化钠溶液混合后,溶液呈 性(填“酸”,“中”或“碱”,下同),溶液中c(Na+) c(CH3COO-)(填“ >” 或“=”或“<”,下同 )。
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈
性,溶液中c(Na+) c(CH3COO-)
(3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈 性,醋酸体积_____ 氢氧化钠溶液体积。
(4)将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后溶液的pH=7,则醋酸溶液中c(H+) 氢氧化钠溶液中c(OH-),m与n的大小关系是m n。
(5)用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是 。(多选、错选不得分)
A.配制标准溶液的氢氧化钠中混有Na2CO3杂质;
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确;
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗;k.s.5.u
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液;
E.未用标准液润洗碱式滴定管。
17.(3分)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接
测得,但可通过间接的方法测定。现根据下列两个热化学反应方程式:
FeO(s)+CO(g)= Fe(s)+ CO2(g) △H= ―218kJ/mol k.s.5.u
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原Fe3O4固体得到Fe固体和CO2气体的热化学反应方程式:
_________________
16.(4分)为更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG=lg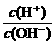 。
。
(1)中性溶液的AG=
(2)常温下0.01mol·L-1盐酸溶液的AG=
0.1mol的氨气
④在25min时平衡正向移动但达到新平衡后NH3的体积分数比原平衡小k.s.5.u
A.①② B.①③ C.②③ D.②④
第II卷 非选择题(共40分)
0.005mol·L-1·min-1
②从曲线变化可以看出,反应进行到10 min至20 min钟时
可能是使用了催化剂
③从曲线变化可以看出,反应进行至25min钟时,分离出
15.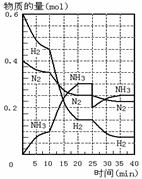 500℃、20 MPa时,将H2和N2置于一容积为2 L的密闭
500℃、20 MPa时,将H2和N2置于一容积为2 L的密闭
容器中发生反应。反应过程中 ( )
H2、N2和NH3物质的量变化如图所示。则下列说法正确的是:
①反应开始到第一次平衡时,N2的平均反应速率为
14.已知AgI为黄色沉淀,AgCl为白色沉淀。25℃时, AgI饱和溶液中c(Ag+)为1.22×10-8
mol·L-1,AgCl饱和溶液中c(Ag+)为1.30×10-5mol·L-1。若在5mL含有KCl和KI浓度均为0.01mol·L-1的混合溶液中,滴加8mL 0.01mol·L-1的AgNO3溶液,则下列叙述中不正确的是 ( )
A.溶液中所含溶质的离子浓度大小关系为:c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-)
B.溶液中先产生的是AgI沉淀
C.AgCl的KSP的数值为1.69×10-10
D.若在AgI悬浊液中滴加少量的KCl溶液,黄色沉淀不会转变成白色沉淀
13.关于下列四个图像的说法中正确的是 ( )


A.图①表示可逆反应“CO(g) + H2O(g) CO2(g)+H2(g)”中的ΔH大于0
CO2(g)+H2(g)”中的ΔH大于0
B.图②是在电解氯化钠稀溶液的电解池中,阴、阳极产生气体体积之比一定为1:1
C.图③表示可逆反应“A2(g)+3B2(g) 2AB3(g)”的ΔH小于0
2AB3(g)”的ΔH小于0
D.图④表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com