
题目列表(包括答案和解析)
8.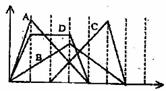 右图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量。下列选项编号与对应的曲线编号错误的是
右图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量。下列选项编号与对应的曲线编号错误的是
A.向NaAlO2溶液中滴入HCl至过量
B.向澄清石灰水中通入CO2至过量
C.向含有盐酸的AlCl3溶液申滴入NaOH溶液至过量
D.向含有等物质的量的Ca(OH)2、KOH的混合溶液中
通入CO2至沉淀消失
7.实验室配制FeSO4溶液并防止变质,其中正确的操作步骤是
①把FeSO4固体溶解在少量蒸馏水中; ②稍加热溶液; ③加蒸馏水稀释;
④把FeSO4固体溶解在少量稀硫酸中: ⑤加入铜屑; ⑥加入铁钉
A.①③⑥ B.①②③⑥ C.④③⑥ D.④②③⑤
6.从海水中提取镁,可按如下步骤进行:
①把贝壳制成石灰乳;
②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物;
③将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物:
④将得到的产物熔融电解得到镁。下列说法不正确的是
A.此法的优点之一是原料来源丰富
B.①②③步骤的目的是从海水中提取镁盐
C.①②③步涉及化合、分解和复分解反应
D.第①到第④步的反应都是氧化还原反应
5.世界组织把铝确定为食品污染源之一,应加以控制使用。下列应用时应加以控制的是
①制铝合金 ②制电线 ③制炊具 ④明矾净水
⑤明矾与苏打制食品膨松剂 ⑥用氢氧化铝凝胶制胃舒平药片
⑦银色漆颜料 ⑧易拉罐 ⑨包装糖果和小食品
A.③⑤⑧⑨ B、①②⑥⑧⑨
C、③⑤⑨ D、③④⑤⑥⑧⑨
4.下列各组中的两物质相互反应时,若改变反应条件(温度、反应物用量比),化学反应的产物不发生改变的是
A.Na和O2 B.NaOH和CO2
C.木炭(C)和O2 D.Na2O2和CO2
3.检验溶液中是否含有某种离子,下列操作方法正确的是
A.加入AgNO3溶液,有白色沉淀生成,证明含有
B.加入BaCl2溶液,产生白色沉淀,证明有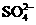
C.加浓NaOH溶液后加热,产生使湿润的红色石蕊试纸变蓝色的气体,证明有
D.加入盐酸,放出能使澄清的石灰水变浑浊的气体,证明有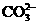
2.关于Na2CO3溶液和NaHCO3溶液,下列说法正确的是
A.浓度相同时,Na2CO3溶液的pH大
B.用澄清的石灰水区别两种溶液
C.用加热的方法区别两种溶液
D.浓度相同时,两溶液的pH相等
1.关于Na2O和Na2O2的叙述正确的是
A.都是碱性氧化物
B.都可以做漂白剂和供氧剂
C.都能和水反应形成强碱溶液
D.都是强氧化剂
说明:1. 测试时间:90分钟 总分:100分
2.客观题涂在答题卡上,主观题答在答题纸上
可能用到的相对原子质量:H l C 12 O 16 Na 23 Mg 24 S 32 C1 35.5
K 39 Ca 40 Cu 64 Fe 56 Zn 65 Ba 137 N 14 Al 27
第I卷(44分)
21.(8分)煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:
 C(s)+H2O(g) CO(g)+H2(g) ;ΔH=+131.3 kJ•mol-1,
C(s)+H2O(g) CO(g)+H2(g) ;ΔH=+131.3 kJ•mol-1,
一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应
达到化学平衡状态的是 (填字母序号)。
a.容器中的压强不变 b.1 mol H-H键断裂的同时断裂2 molH-O键
c.v正(CO) = v逆(H2O) d.c(CO)=c(H2) k.s.5.u
(2)830K时,在密闭容器中发生下列可逆反应:
 CO(g)+H2O(g)
CO2(g)+H2(g) △H<0
CO(g)+H2O(g)
CO2(g)+H2(g) △H<0
试回答下列问题:
①若起始时c(CO)=2 mol·L-1,c(H2O)=3 mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K= .
②在相同温度下,若起始时c(CO)=1 mol·L-1,c(H2O)=2 mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应v(正) v(逆)(填“大于”“小于”或“等于”)
③若降低温度,该反应的K值将 (填“增大”“减小”或“不变”)。
 (3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发
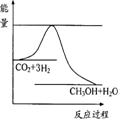 生反应:CO2(g)+(g) CH3OH(g)+H2O(g) ,右
生反应:CO2(g)+(g) CH3OH(g)+H2O(g) ,右
图表示该反应进行过程中能量(单位为kJ•mol-1)的变化。在体
积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措
施中能使c (CH3OH)增大的是________ ___。
a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来 k.s.5.u
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com