
题目列表(包括答案和解析)
4、下列叙述中完全正确的一组是 ( )
①常温常压下,1 mol甲基(-CH3)所含的电子数为10NA
②由Cu、Zn和稀硫酸组成的原电池工作时,若Cu极生成0.2gH2,则电路通过电子0.2NA
③在标准状况下,11.2 L NO与11.2 L O2混合后气体分子数为0.75NA
④常温常压下,16 g O3所含的原子数为NA
⑤1 mol C10H22分子中共价键总数为31 NA
⑥1 mol Cl2发生反应时,转移的电子数一定是2 NA
⑦标准状况下,22.4 L水中含分子数为NA
A、①②③④⑤ B、②④⑤⑥⑦ C、②④⑤ D、①②⑤
3、下列实验操作中,正确的是 ( )
①用托盘天平称取5.2 g NaCl;②用50 mL量筒量取5.2mL盐酸;③用蒸发皿加热NaCl溶液可以得到NaCl晶体;④用 100 mL容量瓶配制50 mL 0.1mol·L-1H2SO4溶液;⑤用带玻璃塞的棕色试剂瓶存放浓HNO3; ⑥中和热测定的实验中使用的玻璃仪器只有2种
A、①③⑤ B、②④⑥ C、①③④ D、③⑤⑥
2、下列过程中,不涉及化学变化的是 ( )
A、杨梅酿酒 B、纸层析法分离Fe3+和Cu2+
C、淀粉遇碘变蓝 D、蛋白质溶液加入CuSO4溶液产生沉淀
1、下列有关化学用语使用正确的是 ( )
A、硫原子的原子结构示意图: B、NH4H的电子式:
B、NH4H的电子式:
C、原子核内有10个中子的氧原子:
 D、乙烯的结构简式:C2H4
D、乙烯的结构简式:C2H4
23.(17分)
铝热反应在生活生产中应用很广泛。
(1)写出铝热反应的应用 ; 。
(2)某研究小组在实验室利用简易装置进行铝热反应,发现生成的铁是疏松的褐色硬块。小组成员推测主要原因是产物铁含杂质较多, 将褐色硬块处理成粉末状。
限选下述试剂:20%KSCN、3mol·L-1NaOH、3mol·L-1HCl、3 mol·L-1H2SO4、3mol·L-1CuSO4 mol·L-1 KMnO4、蒸馏水。以上述粉末为样品,完成以下实验。
研究小组首先排除了含有单质A1杂质的可能性,实验原理是
(用离子方程式表示)。该褐色硬块的组成基本确定为 ,且Fe2O3的物质的量大于Fe物质的量。该研究小组没计实验方案验证其组成巾含有
,且Fe2O3的物质的量大于Fe物质的量。该研究小组没计实验方案验证其组成巾含有 。填空:
。填空:
|
实验操作 |
预期现象和结论 |
|
步骤1:取粉末少许于试管中加入3mol·L-1NaOH过滤 |
现象:固体粉末部分溶解 |
|
步骤2:取过滤后的固体粉末少许于试管中加入过量
|
现象:
结论:无 |
|
步骤3:取步骤2溶液加入
|
现象:
结论;有单质铁 |
|
步骤4:另取步骤2所得溶液加入
|
现象:
结论;有 |
(3)写出步骤3、4反应的离子方程式
。

版权所有:()
版权所有:()

22. (16分)
某化学兴趣小组用含铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体(CuSO4·5H2O),以探索工业废料的再利用。其实验方案如下图:(C气体无色无味)

试回答下列问题:
(1)写出滤液A转化为沉淀D的离子方程式 。
(2)由滤液A制AlCl3溶液的途径有I和II两条,你认为合理的是途径 (填“I”
或“II”),理由是 。
(3)从滤液E中得到绿矾晶体的实验操作是(不考虑E中的溶质被氧化这一以你素):
.
(4)H2O2是一种绿色氧化剂,应用十分广泛,在滤渣F中加入稀硫酸和H2O2来制各胆矾晶体是一种绿色工艺,该反应的总的化学方程式为 。
21. (8分)
(8分)
A、B、C、D.是按原子序数由小到大排列的第二、三周期元素的单质。B、E均为组成空气的成分。F的焰色反应呈黄色。在G中,非金属元素与金属元素的原子个数比为1:2。在。一定条件下,各物质之间的相互转化关系如右(图中部分产物未列出).
请填写下列空白:
(1)A是 ,C是 。
(2)H与盐酸反应生成E的化学方程式是 。
(3)E与F反应的化学方程式是 。
(4)F与G的水溶液反应生成I和D的离子方程式是 。
2.33g。试回答下列问题:
(1)
(2)K+是否存在? ;若存在,浓度 mol/L(若不存在,则不必回答第二问)。
(3)根据以上实验,有没有哪种离子不能判断是否存在? ,若有,这种离子应如何进行检验?
。
20.(8分)
某混合物的水溶液中,只可能含有以下离子中的若干种: 。
。 现每次取100.00mL进行实验。
现每次取100.00mL进行实验。
①第一份加入AgNO3溶液有沉淀产生:
②第二份加足量BaCl2溶液后,得干燥沉淀6.27g,沉淀经足量盐酸洗涤、干燥后,剩
19.(10分)铁及其化合物之间的相互转化可用下式表示:
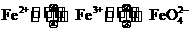 (高铁酸根离子)
(高铁酸根离子)
回答下列有关问题:
(1)Fe与过量稀硫酸反应可以制取FeSO4,在此反应中,氧化产物是 ;用反应所得的酸性溶液,实现上述①的转化,要求产物纯净。可选用的试剂是 :
a、C12 b、Fe c、O3 d、H2O2
(2)下述反应中,若FeSO4和O2的系数比为2:1,配平下列方程式:
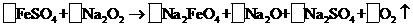
制备0.2mol Na2FeO4,转移电子 mol;
(3)高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,在水中发生反应生成Fe(OH)3。高铁酸钾作为水处理剂发挥的作用是 、 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com