
题目列表(包括答案和解析)
9.
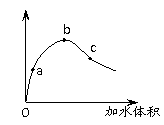 一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如右图所示。有关a、b、c三点的下列说法中正确的是
一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如右图所示。有关a、b、c三点的下列说法中正确的是
A.醋酸的电离程度由大到小的顺序:b>c>a
B.溶液的pH由大到小的顺序: a>c>b
C.用湿润的pH试纸测量醋酸溶液的pH,测量结果均偏大
D.与等浓度NaOH溶液中和,消耗NaOH溶液的体积b最多
8.T°C时,将体积为VAL、浓度为a mol/L的一元酸HA与体积为VBL、浓度为b mol/L的一元碱BOH混合,混合液恰好呈中性,则下列判断正确的是
A.混合液的pH=7 B.a=b C.混合液中Kw=[c(H+)]2 D.a=b,VA=VB
7.在amL浓度为c mol·L-1的AgNO3溶液中加入一定体积的pH=1的盐酸时,恰好使溶液中Ag+完全沉淀,此时得到pH=2的溶液100 mL(设反应前后溶液体积变化忽略不计),则c的值是
A. 0.0020 B. 0.011 C. 0.11 D. 0.22
6. 相同温度下,将足量的AgCl分别放入下列溶液中: ①40mL 0.02mol/L BaCl2溶液 ② 40mL 0.03mol/L 盐酸 ③10mL 蒸馏水 ④ 50mL0.05mol/L AgNO3溶液 则AgCl的溶解度大小顺序为
A. ③ > ② > ① > ④ B.④ > ② > ① > ③
C. ③ > ① > ② > ④ D. ① = ② = ③ = ④
5.三国时代,诸葛亮领兵南征孟获,遇到了“哑泉”,士兵饮后致哑,腹痛,甚至死亡。又有一“安乐泉”,饮后可解“哑泉”之毒。1995年10月国内某报刊报道,经科研人员研究,“哑泉”水中溶有CuSO4,“安乐泉”水质偏碱性。有关说法符合题意的有
①“哑泉”之毒是由于水中的Cu2+使人体中的蛋白质变性
②“哑泉”之毒是由于水中的SO42-使人体中的蛋白质变性
③“哑泉”之毒是由于水中的Cu2+水解显酸性使人体中的蛋白质变性
④“安乐泉”能解“哑泉”之毒的离子方程式为Cu2++ 2OH-=Cu(OH)2↓
A.①④ B.②④ C.③ D.均不正确
4. 元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构。下列推测不正确的是
A. 同周期元素中X的金属性最强 B. 原子半径X>Y,离子半径X+>Z2-
C. 同族元素中Z的氢化物稳定性最高 D. 同周期元素中Y的最高价含氧酸的酸性最强
3. 已知:25℃时,K[Mg(OH)2]=5.61×10-12 ,K[MgF2]=7.43×10-11。下列说法正确的是
A.25℃时,饱和Mg(OH)2溶液与饱和Mg F2溶液相比,前者的c(Mg2+)大
B.25℃时,在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2
C.25℃时,Mg(OH)2固体在20 mL 0.01 mol·L-1氨水中的K比在20 mL 0.01 mol·L-1 NH4Cl溶液中的K小
D. 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
2.下列不是元素电负性的应用的是
A.判断化合物的溶解度 B.判断化合物中元素化合价的正负 C.判断化学键的类型 D.判断一种元素是金属还是非金属
1.下列物质分类正确的是
A.CaCO3难溶于水属非电解质
B.SO2能与碱反应生成盐和水属于酸性氧化物
C.NH4Cl组成中不含金属离子不属于盐
D.HCl气体溶于水电离成H+和Cl-属于离子化合物
23.有三种不同质量比的氧化铜与炭粉的混合物样品①、②、③。甲、乙、丙三同学各取一种样品,加强热充分反应,测定各样品中氧化铜的量。
(1)甲取样品①强热,若所得固体为金属铜,将其置于足量的稀硝酸中微热。产生1.12L气体(标准状况),则样品①中氧化铜的质量为 g。
(2)乙取样品② a g强热,生成的气体不能使澄清的石灰水变浑浊。再将反应后固体与足量的稀硝酸微热,充分反应后,有b g固体剩余,该剩余固体的化学式为 。样品②中氧化铜质量为 g(以含a、b的代数式表示)。
(3)丙称量样品③强热后剩余的固体,质量比原样品减小了c g,若该固体为金属铜,
则样品③中氧化铜物质的量(n)的取值范围为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com