
题目列表(包括答案和解析)
19.下列各组中的两种物质相互反应时,无论哪种过量,都可以用同一个离子方程式表示的是
①碳酸钠溶液与盐酸 ②四羟基合铝酸钠溶液与盐酸 ③二氧化碳与氢氧化钠溶液
④硝酸银溶液和氨水 ⑤氯化铝与氨水 ⑥碳酸氢钠溶液与澄清石灰水
A.③⑤ B.①③⑥ C.仅有⑤ D.②④
18.从下列事实所引出的相应结论,正确的是
|
选项 |
实验事实 |
结论 |
|
A |
等体积pH同为3的酸HA和酸HB与足量Zn反应,酸HA放出氢气多 |
酸性:HA > HB |
|
B |
Na2SO4溶液的pH小于Na2CO3溶液的pH |
非金属性:S > C |
|
C |
电解同浓度的A2+和B2+硝酸盐的混合溶液,A先析出 |
金属性:A > B |
|
D |
由M、N与稀硫酸构成的原电池中,M上产生大量气泡 |
金属性:M > N |
17.下列关于溶液中离子的说法正确的是
A.0.1 mol/L的Na2CO3溶液中离子浓度关系为
c(Na+) = c(HCO3-) + 2c(CO32-) + c(H2CO3)
B.1 L 1 mol·L-1的CH3COOH溶液中,CH3COO-数目为NA
C.金属钠与水反应的离子方程式为 Na + H2O = Na+ + OH- + H2↑
D.向碳酸氢钠溶液中加入少量氢氧化钙,其反应的离子方程式为
2HCO3- + Ca2+ + 2OH- = CaCO3↓+ CO32- + 2H2O
16.下列有关溶液导电性的说法中,不正确的是
A.电解质溶液的导电过程实质上就是电解质溶液的电解过程
B.同物质的量浓度的NaCl溶液与MgCl2溶液的导电能力不同
C.往2mol / L的盐酸溶液中通入少量氨气,溶液的导电能力增强
D.往100mL 1mol / L NaOH溶液中滴加100mL 1mol / L盐酸,溶液的导电性减弱
15.在指定环境中,下列各组离子一定可以大量共存的是
A.使pH试纸呈红色的溶液: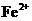 、
、 、
、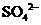 、
、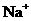
B.常温下,在 的溶液:
的溶液: 、
、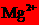 、
、 、
、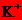
C.加入铝粉放出氢气的溶液: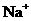 、
、 、
、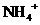 、
、
D.使无色酚酞试液显红色的溶液: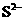 、
、 、
、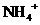 、
、
14. 下列化学反应式书写正确的是
下列化学反应式书写正确的是
A.制取氢氧化铁胶体的化学方程式为 FeCl3 + 3H2O Fe(OH)3 (胶体) + 3HCl
B.亚硫酸在溶液中的电离方程式为 H2SO3 = 2H+ + SO32-
C.NaHCO3水解的离子方程式为 HCO3- + H2O
 CO32-
+ H3O+
CO32-
+ H3O+
D.钢铁发生吸氧腐蚀的正极反应式为 O2 + 4 H+ + 4e- = 2 H2O
13.下列叙述中正确的是
A.同周期的第IIA族和第IIIA族元素的原子序数相差均为1
B.某主族元素在其某种化合物中显+5价,则该元素位于第VA族
C.奇数族元素的常见化合价均为奇数,偶数族元素的常见化合价均为偶数
D.若A元素所在周期有a种元素,B元素所在周期有b种元素,且A、B为同一主族的相邻元素,则A、B的原子序数相差a或b
12.下列溶液中有关微粒的物质的量浓度的比较正确的是
A.常温下两种溶液①0.1mol/L CH3COOH溶液 ②0.3mol/L CH3COOH溶液与0.1mol/LNaOH溶液等体积的混合液, c(H+):①<②
B.常温下将NaHCO3与NaHSO3混合溶于水,恰好呈中性的溶液中:
c(Na+)= c(HCO3-)+c(HSO3-)+2c(CO32-)+2c(SO32-)
C.相同条件下,pH=9的①CH3COONa溶液、②NH3·H2O溶液、③NaOH溶液中,由水电离出的c(OH-):①>②>③
D.已知酸性HF>CH3COOH,物质的量浓度相等的NaF与CH3COOK溶液中:
[c(Na+)-c(F-)] >[c(K+)-c(CH3COO-)]
11.用惰性电极电解下列溶液一段时间后,再加入一定量的另一种物质(括号内),溶液能恢复到与原溶液完全一样的是
A. CuCl2 (CuO) B.NaOH (NaOH) C.NaCl (HCl) D.CuSO4(Cu(OH)2)
10. 离子检验的常用方法有三种:
|
检验方法 |
沉淀法 |
显色法 |
气体法 |
|
含义 |
反应中有沉淀 产生或溶解 |
反应中有 颜色变化 |
反应中有 气体产生 |
下列离子检验的方法不合理的是
A.Fe3+-显色法 B.SO42--沉淀法 C.NH4+-沉淀法 D.OH--显色法
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com