
题目列表(包括答案和解析)
29.(9分)某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。
实验一配制并标定醋酸溶液的浓度
取冰醋酸配制250mL 0.2mol.L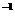 的醋酸溶液,用0.2 mol.L
的醋酸溶液,用0.2 mol.L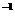 的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题:
的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题:
(1)配制250mL 0.2mol.L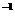 醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、_________
醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、_________
和______________.
(2)为标定某醋酸溶液的准确浓度,用0.2000mol 的NaOH溶液对20.00mL醋酸溶液进
的NaOH溶液对20.00mL醋酸溶液进
行滴定,几次滴定消耗NaOH溶液的体积如下:
|
实验序号 |
1 |
2 |
3 |
4 |
|
消耗NaOH溶液的体积(mL) |
20.05 |
20.00 |
18.80 |
19.95 |
则该醋酸溶液的准确浓度为_____________。(保留小数点后四位)滴定时用____________做指示剂。
实验二探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸的pH,结果如下:
醋酸浓度(mol·L |
0.0010 |
0.100 |
0.0200 |
0.1000 |
0.2000 |
|
pH |
3.88 |
3.38 |
3.23 |
2.88 |
2.73 |
回答下列问题:
(1)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是
_____________________________________________________________________________________________________________________________________________________________.
(2)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度
____________。(填增大、减小或不变)
实验三探究温度对醋酸电离程度的影响
请你设计一个实验完成该探究,请简述你的实验方案________________________________
_____________________________________________________________________________________________________________________________________________________________.
28.(5分)物质的分离是化学研究中常用的方法,填写下列物质分离时需使用的方法(不必叙述操作细节)。
(1)两种互不相溶的液体的分离 。
(2)固体和液体的分离 。
(3)含固体溶质的溶液中除去部分溶剂 。
(4)胶体中分离出可溶电解质 。
(5)几种沸点相差较大的互溶液体的分离 。
27.(11分)回答下列各小题:
(1)已知NaHSO4在水中的电离方程式为 NaHSO4 =Na+ + H+ + SO42- 。在NaHSO4溶液中c(H+) c(OH-)+ c(SO42-)(填 “>”、“=”或“<”)。
(2)常温下,向1.0mol / L的NaHSO4溶液中逐滴加入等物质的量浓度的Ba(OH)2溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图
所示。a、b、c、d分别表示实验时不同阶段的溶液。
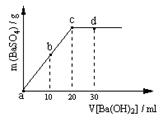 其中b点所示溶液呈
(填“酸性”、“中性”或“碱性”),c点所示的离子方程式为
。
其中b点所示溶液呈
(填“酸性”、“中性”或“碱性”),c点所示的离子方程式为
。
(3)在t℃时,将NaHSO4晶体加入到pH= 6的蒸馏水中,保持温度不变,测得溶液的pH为2。t℃将 25℃(填“高于”或“低于”),Kw为 ,在该溶液中由水电离出的c(H+)为 mol / L。t℃时,将pH =11的NaOH溶液V1L与pH =1的H2SO4溶液V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH =2,则V1∶V2 = ,此溶液中各种离子的浓度由大到小的排列顺序为 。
(4)0.1mol / L pH为4的NaHB溶液中①c(H2B)、②c(HB-)、③c(B2-)由大到小的顺序为 (填序号)。
(5)在0.1mol / L的①(NH4)2SO4溶液、②NH4HCO3溶液、③NH4HSO4溶液、④NH4Cl溶液中,c (NH4+)由大到小的排列顺序为 (填序号)。
26. 下列说法正确的是
A. 将AlCl3溶液、Na2SO3溶液蒸干并灼烧可分别得到Al2O3、Na2SO3
B. 在溶液的稀释过程中,离子浓度有的可能增大,有的可能减小,有的可能不变
C. 0.1
mol/L CH3COOH溶液在稀释过程中 将变小
将变小
D. 镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀
25.在某未知溶液中检验出含有Ba2+、NO3-,且溶液的pH = 1。某学生还需鉴定此溶液中是否大量存在①Al3+ ②NH4+ ③Fe2+ ④Cl- ⑤AlO2- ⑥SO42- 其实这些离子中有一部分不必再鉴定就能加以否定,你认为不必再鉴定的离子组是
A.③⑤⑥ B.④⑤⑥ C.①②⑤ D.①③④
24.有一无色溶液,可能含有K+、A13+、Mg2+、NH4+、Cl―、SO42―、HCO3―、MnO4― 中的几种。为确定其成分,做如下实验:①取部分溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3) 2溶液,有白色沉淀产生。下列推断正确的
A.肯定有A13+、Mg2+、NH4+、Cl― B.肯定有A13+、Mg2+、HCO3―
C.肯定有K+、HCO3― 、MnO4― D.肯定有A13+、Mg2+、SO42―
23.下列四种短周期元素中,其单质氧化性最强的是
A.元素周期表中第三周期ⅢA族元素
B.原子最外层电子数比次外层电子数多5的元素
C.原子M层电子数比L层电子数少1的元素
D.原子最外层为第n层,最外层有2n2个电子的元素
22.A、B是短周期ⅦA族元素,元素A的非金属性比B强,下列有关A、B说法中正确的是
A.NaA、NaB的晶体都是离子晶体
B.单质A可把B从NaB的溶液中置换出来
C.HA比HB沸点高的原因是1molHA分子中H-A键断裂时需要吸收的能量比1molHB分子中H-B键断裂时需要吸收的能量多
D.常温下,NaA、NaB溶液的pH均大于7
21.目前人类已发现的非金属元素除稀有气体外,共有16种,下列对这16种非金属元素的相关判断正确的是
①都是主族元素,最外层电子数都大于4
②单质在反应中都只能作氧化剂
③其氢化物常温下都是气态,所以又都叫气态氢化物
④其氧化物常温下都可以与水反应生成酸
A.只有①②正确 B.只有①③正确 C.只有③④正确 D.①②③④均不正确
20.下列说法正确的是
①质子数相同的粒子一定属于同种元素;②电子数相同的粒子不一定是同一种元素;③一种元素只能有一种质量数;④某种元素的相对原子质量取整数,就是其质量数;⑤质子数相同,电子数也相同的粒子,不一定是一种分子和一种离子;⑥同位素的性质几乎完全相同。
A.①③④⑥ B.①②④⑤ C.②③⑤⑥ D.②⑤
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com