
题目列表(包括答案和解析)
7.在下列变化过程中,既有离子键被破坏又有共价键被破坏的是
A.将SO2通入水中 B.烧碱溶于水 C.将HCl通入水中 D.硫酸氢钠溶于水
6.常温下,下列各组离子在指定环境下能大量共存的是
A.pH = 1的溶液中:Na+、K+、SO32-、MnO4-
B.pH = 7的溶液中:Na+、Al3+、Cl-、SO42-
C.pH>12的溶液中:Na+、K+、SO32-、[Al(OH)4]-
D.pH = 0的溶液中:Na+、K+、NO3-、ClO-
5.在空气中久置而不易变质的物质是
A.过氧化钠 B.纯碱 C.硅酸钠溶液 D.亚硫酸钠
4. 已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为:
C(石墨)+O2(g)=CO2(g);ΔH= -393.51 kJ.mol-1
C(金刚石)+O2(g)=CO2(g);ΔH= -395.41 kJ.mol-1
据此推理所得到的下列结论正确的是
A.金刚石的燃烧热比石墨的燃烧热小
B.石墨晶体中碳碳键的强度小于金刚石中的碳碳键
C.石墨的能量比金刚石的能量高
D.由石墨制备金刚石一定是吸热反应
3.下列实验数据记录和实验方法正确的是
A.用天平称取4.0gNaOH固体,用100mL量筒配制1.00mol/L的NaOH溶液
B.用25mL的滴定管(内装有标准NaOH溶液)滴定未知浓度的盐酸用去NaOH溶液22.32mL
C.用pH试纸测得新制氯水的pH为4
D.常温下,用气球收集500mLNO2气体,求得NO2气体的物质的量为(0.5/22.4)mol
2. 常温下 ,能用铝制品容器盛装的药品是
A.浓硫酸 B.浓盐酸 C.稀硝酸 D.硫酸铜溶液
1.下列说法正确的是 ( )
A.凡有能量变化的过程都是化学变化
B.吸热反应只能在加热条件下才能进行
C.放热反应可能需要加热才能进行
D.天然气在空气中燃烧时,其化学能将全部转化为热能
32. (6分)
已知X、Y、Z、Q、E五种元素的原子序数依次增大,其中X原子核外电子有6种不同的运动状态,s能级电子数是P能级电子数的两倍;Z原子L层上有2对成对电子;Q是第三周期中电负性最大的元素;E+的M层3d轨道电子全充满。请回答下列问题:
(1)X、Y、Z第一电离能由小到大的顺序为____<____<____ (填元素符号)。
(2)E元素基态原子的电子排布式为________________________________。
(3)XZ2分子中含有________个π键。
(4)Z氢化物的沸点比Q氢化物的沸点高,理由是_________________________
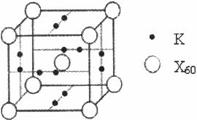 (5)X元素可形成X60.单质,它与金属钾掺杂在一起
(5)X元素可形成X60.单质,它与金属钾掺杂在一起
制造了一种富勒烯化合物,其晶胞如图所示(白
球位于立方体的体心和顶点,小黑球位于立方体
的面上),该化合物中X60与钾原子个数比
为____________
[附加题]第四周期元素的单质及化合物在工农业生产中应用广泛。
(1)第四周期元素中,基态原子的最外层只有1个电子的元素共有 种。
(2)铂丝蘸取氯化钙在酒精灯上灼烧,火焰呈现砖红色,显色原因是 (填序号)。
A.氯化钙受热挥发 B.氯化钙受热分解
C.钙离子中电子跃迁 D.氯离子中电子跃迁
(3)无水硫酸铜呈白色,吸水后形成胆矾,呈蓝色。科学家通过X射线测定出胆矾的结构,其结构可用右图表示
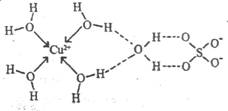
①胆矾晶体中除共价键、配位键及微弱的范德华力外,还存在的两种作用力是 和 。
②铜离子形成胆矾中配位离子的离子方程式为
。
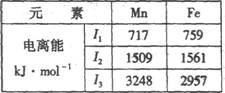
(4)Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据如下表。据表判断Mn2+和Fe2+再失去-个电子的难易,并从原子结构的角度筒述其原因 
福建省三明一中2010届高三上学期第二次月考
31. (7分)已知某无色溶液中只含有包括Na+、CH3COO-在内的四种离子,请回答下列问题:
(1)若该溶液中只含有一种溶质,则该溶液显
性
相关的离子方程式为 。
(2)若该溶液呈酸性,则溶液中的溶质为 。
(3)若溶液中含有两种溶质,且溶液呈碱性,则该溶液中不可能出现的离子浓度大小关系是 。(选填编号字母)
A.c(Na+)>c(CH3COO-) B.c(CH3COO-)> c(Na+) C.c(OH-)> c(Na+)
D.c(Na+)> c(OH-) E.c(OH-)>c(CH3COO-) F. c(CH3COO-)> c(OH-)
30.(10分)A、B、C、D都是短周期元素,它们的原子序数依次增大。已知:元素A的原子最外层电子数是最内层电子数的两倍;元素B是地壳中含量最高的元素;元素B、C的原子的最外层电子数之和等于元素D的原子的最外层电子数。甲、乙两种化合物分别由元素C与B、C与D组成。甲与水反应或者电解乙的水溶液,都将得到可溶性化合物丙。丙是一种离子化合物,构成该物质的阴、阳离子都含10个电子。回答下列问题:
(1)A原子的结构示意图为 ;B元素在周期表中的位置为 ;
甲中一定含有的化学键为 ;丙的电子式为 ;D的单质的结构式为 ;A与B所形成稳定化合物的分子为 分子(填“极性”或“非极性”)。
(2)若甲与水反应能生成气体,则该反应中还原剂是 ,1mol甲参与反应时转移电子为 mol。
(3)由A、B、C三种元素所组成的常见化合物,在水中发生水解反应的离子方程式为:
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com