
题目列表(包括答案和解析)
22、右图是198K 时N2与H2反应过程中能量变化的曲线图。下列叙述正确的是
A. 该反应的热化学方程式为:N2
+ 3H2  2NH3, △H = -92kJ·mol-1
2NH3, △H = -92kJ·mol-1
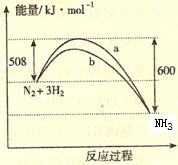 B. a曲线是加入催化剂时的能量变化曲线
B. a曲线是加入催化剂时的能量变化曲线
C. 加入催化剂, 该化学反应的反应热改变
D. 在温度体积一定的条件下, 通入lmol N2和3molH2 反应后放出的热量为Q1kJ, 若通入2mol N2和6mol H2 反应后放出的热量为Q2kJ 则184>Q2 >2Q1
第II卷
(1)A的一种氢化物与B单质的摩尔质量相等,则A的氢化物的分子式为 ;A的另一种氢化物与B的一种氢化物的电子总数相等,实验室制取A的该气态氢化物的化学方程式为 。
(2)B与C按原子个数比1∶1所形成化合物的电子式为 。
(3)由上述五种元素中的三种组成的某种盐,水溶液显碱性,是家用消毒剂的主要成分。将该盐溶液滴入KI淀粉溶液中,溶液变为蓝色,则反应的离子方程式为 。
(4)D单质能与C的最高价氧化物的水化物浓溶液反应放出氢气,写出该反应的离子方程式
___________________________________写出D元素在周期表中的位置______________________
(5)E的最高价氧化物为无色液体,0.5 mol 该物质与一定量水混合得到一种稀溶液,并放出Q kJ 的热量。写出该反应的热化学方程式:
_____________________________________________________________________
24(14分)、将不同量的H2O(气) 和CO
气体分别通入到一体积为l L的恒容密闭容器中进行反应:H2O (g) +
CO( g)  CO2 (g)
+H2(g);得到以下三组数据,据此回答下列问题:
CO2 (g)
+H2(g);得到以下三组数据,据此回答下列问题:
|
实验组 |
温度 |
起始量 |
平衡量 |
达到平衡所需时间 |
||
|
H2O |
CO |
H2 |
CO |
|||
|
1 |
650℃ |
1
mol |
2
mol |
0.8
mol |
1.2
mol |
5
min |
|
2 |
900℃ |
0.5
mol |
1
mol |
0.2
mol |
0.8
mol |
3
min |
|
3 |
900℃ |
a |
b |
c |
d |
t |
( 1 ) ①由以上数据,实验1中以v( CO2) 表示的反应速率为 。
②该反应在650℃时平衡常数数值为 ,该反应的逆反应为 (填“吸” 或“放”)热反应。
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t < 3min,
则a、b 应满足的关系是 。
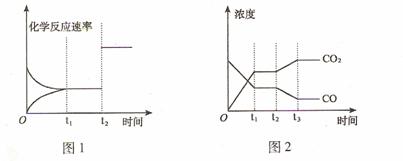 (2)下图1、2 表示上述反应在时刻t1达到平衡,在时刻t2因改变某个条件而发生变化的 情况: ①图1中时刻t2发生改变的所有可能的条件是
。
(2)下图1、2 表示上述反应在时刻t1达到平衡,在时刻t2因改变某个条件而发生变化的 情况: ①图1中时刻t2发生改变的所有可能的条件是
。
②图2中时刻t2发生改变的所有可能的条件是 。
(3) 在850℃时,其平衡常数K = 1,850℃时在该容器中同时充入1.0molCO,3.0 molH2O,1.0molCO2,5.0molH2,此时反应向 (填“正反应” 或“逆反应”)方向进行,平衡时CO2的物质的量为 。
25(4分)、下面所列的是中学化学实验室中几种常见的仪器:酸式滴定管、碱式滴定管、温度计、量筒、托盘天平(附砝码)、 普通漏斗、烧杯、 玻璃棒。
① 若用称量好的NaOH固体配制500mL 0.1mol/L的NaOH溶液,还缺少的仪器和用品有______
若俯视刻度线定容,则所配溶液的浓度 (填偏大、偏小或无影响)
②用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是 。
A. 配制标准溶液的氢氧化钠中混有Na2CO3杂质
B. 滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C. 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液 E. 未用标准液润洗碱式滴定管
26(7分)、已知Cu2O是一种碱性氧化物, 溶于稀硫酸生成Cu和CuSO4, 在空气中加热生成CuO
某课外小组的同学经实验分析,确定某红色粉末为Fe2O3和Cu2O的混合物。
(1) 实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg( b > a),则混合物中Cu2O的质量分数为 。
(2)实验小组欲利用该红色粉末制取较纯净的胆矾(CuS04 · 5H20) 。经查阅资料得知:pH≥9.6时 Fe2+完全沉淀 pH≥6.4时 Cu2+完全沉淀 pH≥3.7时 Fe3+完全沉淀,实验室有下列试剂可供选择:A. 氯水 B. H2O2 C. NaOH D. Cu2(OH)2CO3
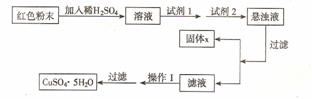 实验小组设计如下实验方案:
实验小组设计如下实验方案:
试回答:
① 试剂1为 ,试剂2为 (填字母)。
② 固体X的化学式为 。
③ 操作I为 。
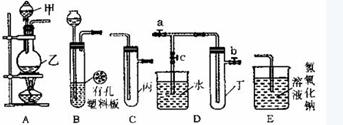 27(20分)、某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹)。
请按要求填空:
(1)利用B装置可制取的气体有_______________ (写出两种即可)。
(2)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验。
①若在丙中加入适量水,即可制得氯水。将所得氯水分成两分,进行实验I、II两个实验,实验操作、现象、结论如下:
27(20分)、某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹)。
请按要求填空:
(1)利用B装置可制取的气体有_______________ (写出两种即可)。
(2)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验。
①若在丙中加入适量水,即可制得氯水。将所得氯水分成两分,进行实验I、II两个实验,实验操作、现象、结论如下:
|
实验序号 |
实验操作 |
现象 |
结论 |
|
I |
将该氯水滴入品红溶液 |
|
氯气与水反应的产物有漂白性 |
|
II |
在该氯水中加入NaHCO3粉末 |
|
氯气与水反应的产物具有较强的酸性 |
②请利用上述装置设计一个简单的实验验证Cl-和Br-的还原性强弱(分别指出甲、乙、丙中盛装的试剂、实验现象及结论)。
|
|
甲 |
乙 |
丙 |
|
试剂 |
|
|
|
|
实验现象 |
|
|
|
|
实验结论 |
|
③ 写出A装置中有关反应的离子反应方程式:
_________________________________________________________
(3)B、D、E装置相连后,在B中盛装浓硝酸和铜片(放在有孔塑料板上),可制得NO2并进行有关实验。 ①B中发生反应的化学方程式为___________________________________________。
②将B中乳胶管与D中a处乳胶管相连组装仪器进行实验,欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹___________ ,再打开止水夹______ ,使烧杯中的水进入试管丁的操作是______________________________________________________
③试管丁中的NO2与水充分反应后,若向试管内缓缓通入一定量的O2,直至试管全部充满水,则所得溶液中溶质的物质的量浓度是__________________ (气体按标准状况计算)。
21、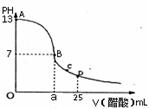 在25mL0.1mol/LNaOH溶液中逐滴加入0.2mol/L醋酸溶液,曲线如下图所示,有关粒子浓度关系比较正确的是
在25mL0.1mol/LNaOH溶液中逐滴加入0.2mol/L醋酸溶液,曲线如下图所示,有关粒子浓度关系比较正确的是
A.在A、B间任一点,溶液中一定都有
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.在B点,a=12.5,且有c(Na+) = c(CH3COO-)﹥c(OH-) = c(H+)
C.在C点,c(CH3COO-)> c(Na+)>c(H+)>c(OH-)
D.在D点,c(CH3COO-) + c(CH3COOH) >2c(Na+)
20、25℃时,在含有大量Ba2+的某澄清透明溶液中,由水电离产生的OH-物质的量浓度为1×10-12mol/L,则在此溶液中还可能大量共存的离子组有
A.Na+、Fe2+、NO3- B.K+、CH3COO-、SO42-
C.NH4+、HCO3-、SCN- D.Cu2+、Mg2+、Cl-
19、在一定温度下,已知有关某溶液的一些数据:①溶液的质量,②溶剂的质量,③溶液的体积,④溶质的摩尔质量,⑤溶质(气体)的体积(Vm已知),⑥溶液的密度,⑦溶液的质量分数.利用下列各组数据计算该溶液的物质的量浓度,不能算出的一组是
A.③⑤ B.②④⑤⑥ C.①④⑥ D.①②③④
18、能实现下列物质间直接转化的元素是
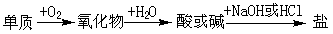

A. 硅
B. 硫
C. 铜
D. 铁
17、对于化学反应方向的确定,下列说法正确的是
A.在温度、压强一定的条件下,焓因素和熵因素共同决定一个化学反应的方向
B.温度、压强一定时,放热的熵增加的反应一定不能自发进行
C.反应焓变是决定反应能否自发进行的唯一因素
D.固体的溶解过程仅与焓变有关
16、常温下,有关下列溶液的叙述正确的是
A.100 mL pH=12的NaOH溶液中加入pH=2的HA至pH刚好等于7,所得溶液的总体积V ≥ 200 mL
 B.等浓度、等体积的Na2CO3溶液与盐酸混合后,存在如下关系:
c(Na+)>c(HCO )=
c(Cl-)>c(OH-)>c(H+)
B.等浓度、等体积的Na2CO3溶液与盐酸混合后,存在如下关系:
c(Na+)>c(HCO )=
c(Cl-)>c(OH-)>c(H+)
C.AgCl沉淀可以转化为AgI沉淀,则说明溶解度AgI>AgCl
D.pH相等的①NH4Cl、②(NH4)2SO4、③NH4HSO4三种物质的溶液中,c(NH4+)大小关系为①=②>③
15、25 ℃时,浓度均为0.2 mol·L-1的NaHCO3和Na2CO3溶液中,下列判断不正确的是
A.均存在电离平衡和水解平衡  B.存在的粒子种类相同
B.存在的粒子种类相同
C.c(OH-)前者大于后者  D.分别加入NaOH固体,恢复到原温度,c(CO32-)均增大
D.分别加入NaOH固体,恢复到原温度,c(CO32-)均增大
14、X、Y、Z、W为原子序数由小到大排列的短周期元素,X、Y同主族,Z、W同周期。下列说法正确的是(m、n均为正整数)
A.若Z(OH)n为强碱,则W(OH)m也一定为强碱
B.若HnXOm为强酸,则W的气态氢化物溶于水一定显酸性
C.若Z、W为金属元素,Z的单质一定能从W的盐溶液中置换出W的单质
D.若Z的最高正价为+4,Z的最高价氧化物一定不与水反应
13、下列离子方程式正确的是
A.向NaHSO4溶液中滴加过量Ba(OH)2溶液:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
B.用氨水吸收少量二氧化硫:SO2+2NH3·H2O=2NH4++SO32-+H2O
C.向FeCl3溶液中加入铜片:Fe3++Cu=Fe2++Cu2+
D.向碳酸氢钠溶液中加入氢氧化钠:HCO3-+ OH-==CO2↑+H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com