
题目列表(包括答案和解析)
2.某混合气体由两种气态烃组成。取2.24L该混合气完全燃烧后得到4.48L二氧化碳(气体已折算为标准状况)和3.6g水,则这两种气体可能是 ( )
A.CH4和C3H8 B.CH4和C3H4
C.C2H2和C3H4 D.C2H2和C2H6
请学生应用上题小结技巧解题。
讨论:
①平均分子式法
②差量法
③十字交叉法
④讨论法等
⑤……
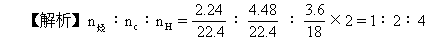

即该烃平均分子组成为C2H4。
讨论:A中含H>4,C中含C>2,而B、D符合题意。
精选题
1.常温下一种烷烃A和一种单烯烃B组成混合气体,A或B分子最多只含有4个碳原子,且B分子的碳原子数比A分子的多。
(1)将该混合气体充分燃烧在同温、同压下得2.5LCO2,试推断原混合气体中A和B所有可能的组合及其体积比。
解析:
设平均分子式为CxHy(用平均值分析法)
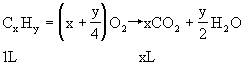

根据题意X=2.5,平均分子式为C2.5Hy。
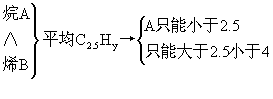



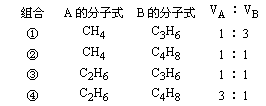
VA∶VB可用十字交叉法迅速求解。
(2)120℃时取1L该混合气体与9L氧气混合,充分燃烧后,当恢复到120℃和燃烧前的压强时,体积增大6.25%,试通过计算确定混合气中各成分的分子式。
(2)由C2.5Hy燃烧反应方程式求出y值。
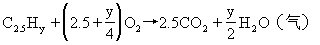

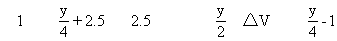

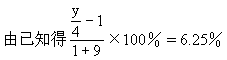

解得y=6.5,平均分子式为C2.5H6.5,讨论只有④组符合题意。
[组织讨论]解此题用到哪些方法及技巧。
[投影]
例1 10mL某种气态烃在50mL氧气中充分燃烧,得到液态水和体积为35mL的混合气体(气体体积均在同温、同压下测得),该气态烃可能是什么烃?
分析题意,讨论解法。
解:
10mL气态烃在50mLO2中充分燃烧,O2应为足量或过量,得到35mL混合气体应为CO2和O2。
解:设气态烃为CxHy


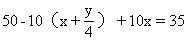

y=6
讨论:y=6时的气态烃有
C2H6 C3H6 C4H6
分析:1mol C3H6完全燃烧消耗O2(4+6/4)=5.5mol,不合题意,舍去。
[评价]同学的解题思路比较好,这是应用到了讨论法。是否还有其他方法,比如差量法、解不等式法等,请同学们回去练习。[投影]
例2 两种气态烃组成的混合气体0.1mol,完全燃烧得0.16molCO2和3.6g水,混合气体中 ( )
A.一定有甲烷 B.一定是甲烷和乙烯
C.一定没有乙烷 D.一定有乙炔
[组织讨论]根据平均化学式C1.6H4分析哪个选项是正确的。
解:设气态烃为CxHy。


1mol x mol 9yg
0.1mol 0.16 mol 3.6 g
解得 X=1.6
y=4即平均化学式为C1.6H4因为只有甲烷碳原子数小于1.6,故一定有甲烷,乙烷氢原子数大于4,故一定没有乙烷。
答案为 A、C。
[指导学生解题]分析该题应用到的方法和技巧是:平均化学式法及讨论法。(指出)解决一道题可能要用到多种方法和技巧,如平均式量法、守恒法、十字交叉法等。
[习题]
2.两种气态烃以任意比例混合在105℃时1L该混合物与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10L,下列混合烃中不符合此条件的是 ( )
A.CH4、C2H4 B.CH4、C3H6
C.C2H4、C3H4 D.C2H2、C3H6
应用规律解题。
答案为B
部分同学答案为B、D
[组织讨论]分析正确答案及其原因。
[过渡]除以上烃及烃的衍生物充分燃烧,判断消耗氧气的量,生成CO2及H2O的量的问题外,还有一些其它方面的计算,下面就这些内容小结其解题常用的技巧及方法。
因为题目限定气态烃以任意比例混合,而C2H2、C3H6只有在1∶1混合时氢原子数才可能为4,故不符合条件。所以答案应是B。
思考:还经常遇到哪些有机物燃烧计算的问题?
聆听、思考。
[提问]分别写出CH4、C2H4、C2H2、C2H6完全燃烧的化学方程式。如果温度高于100℃,分析燃烧反应前后气体体积的变化情况。
写出有关反应的化学方程式,并分析:
CH4+2O2→CO2+2H2O
C2H4+3O2→2CO2+2H2O
C2H2+2.5O2→2CO2+H2O
C2H6+3.5O2→2CO2+3H2O
通过分析找出一般规律。
设烃CxHy为1mol
y=4,总体积不变,△V=0
y<4,总体积减小,△V=1-y/4
y>4,总体积增大,△V=y/4-1
[评价]评价学生的分析,指出如果温度低于100℃生成液态水,则不符合此规律,具体情况可通过化学方程式分析。
[练习]
1.120℃时,1体积某烃和4体积O2混合,完全燃烧后恢复到原来的温度和压强,体积不变,该烃分子式中,所含碳原子数不可能的是
( )
A.1 B.2 C.3 D.4
应用有关规律解题:
因为反应前后气体体积不变,所以氢原子数应为4。氢原子数为4时碳原子数可以为1.CH4,2.C2H4,3.C3H4,不能为4,答案为D。
[评价]对学生解题思路进行评价。
[投影]
例1 等质量的下列烃完全燃烧时消耗氧气的量最多的是
( )
A.CH4 B.C2H4
C.C2H6 D.C6H6
思考。
讨论如何求解。
方法1:常规法根据燃烧的化学方程式求解。
答案为A。
同老师一起分析,并小结有关规律。
小结规律:将CxHy转换为CHy/x,相同质量的烃完全燃烧时y/x值越大,耗氧量越高,生成水的量越多,而产生的CO2量越少。y/x相同,耗氧量,生成H2O及CO2的量相同。
方法2:
根据上述规律解题。
答案为A
小结规律:等质量具有相同最简式的有机物完全燃烧时其耗氧量相等。燃烧产物相同,比例亦相同。


成CO2与H2O的量均相同。
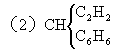

(3)CH2 各种烯烃
[评价]方法1费时费力。
[讲述]C+O2→CO2
12g 1mol
12H+3O2→6H2O
12g 3mol
可见同质量的碳元素、氢元素分别完全燃烧,氢元素耗氧是碳元素的3倍,质量相同的各类烃完全燃烧时,含氢量越高耗氧量越多。
[提问]请学生根据规律举几例并分析原因。
分析原因:因为最简式相同,各元素的质量分数一定相等,有机物质量相同,各元素的质量一定相同。但一定要注意最简式不同,某元素的质量分数可能相同。(如:CH4,C8H16O碳元素质量分数相等)
[评价]分析得很好。
[应用规律解题]
[投影]
例1 A、B是分子量不相等的两种有机物,无论以何种比例混合只要总质量不变,完全燃烧后产生H2O的质量也不变。试写出两组符合上述情况的有机物的分子式_____。并回答应满足的条件是____。
分析题意:只要混合物质量不变完全燃烧后产生水的质量也不变,应满足的条件是氢元素的质量分数相等。符合情况的两组为:
1.C2H2和C6H6;2.CH2O和C2H4O2。
[评价]同学们解题是正确的。应注意C12H8和C2H4O3也符合题意。一定要注意满足的条件不能是最简式相同。
[投影]
例2 有机物A、B分子式不同,它们只可能含C、H、O元素中的三种或两种。如果将A、B不论以何种比例混合,只要物质的量之和不变,完全燃烧时所消耗的氧气和生成的水的物质的量也不变,那么A、B组成必须满足的条件是____。若A是甲烷则符合上述条件的化合物B中分子量最小的是_____。(写出分子式)
在教师指导下,应用有关规律解题。分析:A、B应为CxHy或CxHOz。只要混合物物质的量之和不变,完全燃烧时消耗氧气和生成水的物质的量也不变,则两种有机物分子中含氢原子个数相等。若A为CH4,则B一定为CH4(CO2)n。其中分子量最小的B一定为CH4(CO2),即C2H4O2。
答案为:A、B的分子中氢原子数相同,且相差n个碳原子,同时相差2n个氧原子。
[设问]如果A、B碳原子数相等会如何?如果燃烧时消耗氧气的量相同,那么A、B将满足什么条件?
思考回答问题:生成CO2的量相同。
A、B分子中碳原子数相同,且相差2n个氢原子同时相差n个氧原子。
[过渡]气态烃完全燃烧前后气体体积是怎样变化呢?
2.思考。
讨论:同碳数的烯与饱和一元醇;同碳数的炔与饱和一元醛
如C2H4 C2H6O
C2H2 C2H4O
归纳小结:应符合烃的含氧衍生物与烃差n个水分子。还要看该种衍生物是否存在。
[设疑]相同质量的烃或烃的衍生物完全燃烧时,是否也符合这些规律?
[引入]
1.审题,应用规律求解。
答案为B、D。
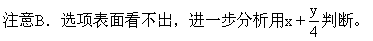

2.某烃或某烃含氧衍生物只要含有的碳原子数相同,当它们以等物质的量分别充分燃烧时,所消耗氧气的量相等,则烃是___________ ,烃的衍生物是_________。
[投影]
例1 等物质的量下列烃完全燃烧时耗氧气的量最多的是_______,生成水最少的是__________。
A.CH4 B.C2H4 C.C2H2 D.C6H6
请学生通过解题小结,等物质的量的烃分别燃烧消耗氧气生成CO2及H2O的量的有关规律。
学生活动
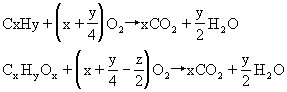

归纳小结:

根据燃烧通式求解:答案为D、C。
小结规律:等物质的量烃完全燃烧时耗氧量取决于x与y的值,生


[投影]
例2 等物质的量的下列有机物完全燃烧时,消耗氧气的量最多的是
( )
A.甲烷 B.乙醛
C.乙二醇 D.乙醇
指导学生讨论解题方法。
讨论方法:
方法1 利用燃烧通式
①先写出化学式A.CH4,B.C2H4O,C.C2H6O2,D.C2H6


解,答案为D。
[评价]
[设问]能否将含氧衍生物转换为烃或只含碳来考虑,为什么?
思考、回答。
能。等物质的量的分子式为CmHn的烃与分子式可转换为CmHn(H2O)x的含氧衍生物,分别燃烧时耗氧的量相同。
[评价]利用此方法解决这类题的优点是:方便、快捷。
方法2.先做转换
(B)C2H4O→C2H2(H2O)
(C)C2H6O2→C2H2(H2O)2
(D)C2H6O→C2H4(H2O)
只需比较A为CH4,B、C相同为C2H2,D转化为C2H4,耗氧

[练习]
1.下列各组有机物,不管它们以何种比例混合,只要物质的量一定,则完全燃烧时消耗氧气为一定值的是 ( )
A.C4H6 C3H8
B.C5H10 C6H6
C.C2H6O C2H4O2
D.C3H6 C3H8O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com