
题目列表(包括答案和解析)
9. 下列各离子组在指定条件下一定能共存的是( )
下列各离子组在指定条件下一定能共存的是( )
 A.常温条件下某无色溶液含有:Ba2+,Fe3+,NO3-,Cl-
A.常温条件下某无色溶液含有:Ba2+,Fe3+,NO3-,Cl-
 B.pH=0的溶液中,Na+,Fe2+,SO42-,CLO-
B.pH=0的溶液中,Na+,Fe2+,SO42-,CLO-
 C.常温下,由水电离出来的C(H+)=10-12mol/L的溶液中:K+,Na+,CLO4-,NO3-
C.常温下,由水电离出来的C(H+)=10-12mol/L的溶液中:K+,Na+,CLO4-,NO3-
 D.使甲基橙溶液变红的溶液中Na+,K+,S2-,I-
D.使甲基橙溶液变红的溶液中Na+,K+,S2-,I-
8. 下列各组物质稀溶液相互反应。无论前者滴入后者,还是后者滴入前者,反应现象相同,且离子方程式也相同的是( )
下列各组物质稀溶液相互反应。无论前者滴入后者,还是后者滴入前者,反应现象相同,且离子方程式也相同的是( )
 A.Ba(HCO3)2溶液与Ba(OH)2溶液 B.NaAl02溶液与稀硫酸溶液
A.Ba(HCO3)2溶液与Ba(OH)2溶液 B.NaAl02溶液与稀硫酸溶液
 C.Ca(HCO3)2溶液与NaON溶液
D.氨水与硝酸银溶液
C.Ca(HCO3)2溶液与NaON溶液
D.氨水与硝酸银溶液
7. NA表示阿伏加德罗常数的值,下列有关叙述正确的是( )
NA表示阿伏加德罗常数的值,下列有关叙述正确的是( )
 A.1mol金属镁晶体中含有2NA个自由电子
A.1mol金属镁晶体中含有2NA个自由电子
 B.1mol石墨晶体中含有共价键键数为3NA
B.1mol石墨晶体中含有共价键键数为3NA
 C.1mol
Zn与足量的盐酸反应生成NA个氢分子,体积约为22.4L
C.1mol
Zn与足量的盐酸反应生成NA个氢分子,体积约为22.4L
 D.含CH3COON和CH3COONa的总物质的量为0.1mol的混合溶液中,CH3COOH分子和 CH3COO-离子总个数为0.1NA
D.含CH3COON和CH3COONa的总物质的量为0.1mol的混合溶液中,CH3COOH分子和 CH3COO-离子总个数为0.1NA
6. 下列叙述正确的是( )
下列叙述正确的是( )
 A.10g质量分数10%的盐酸蒸发掉5g水可得质量分数为20%的盐酸
A.10g质量分数10%的盐酸蒸发掉5g水可得质量分数为20%的盐酸
 B.25℃ pH=12的Ba(OH)2溶液和0.001mol/L的硫酸溶液混合,当混合液的pH=11时,V[Ba(0H)2(aq)]:V[H2S04(aq)]=3:9
B.25℃ pH=12的Ba(OH)2溶液和0.001mol/L的硫酸溶液混合,当混合液的pH=11时,V[Ba(0H)2(aq)]:V[H2S04(aq)]=3:9
 C.0.1mol/L的CH3COONa溶液中C(H+)=COH-)+C(CH3COOH)
C.0.1mol/L的CH3COONa溶液中C(H+)=COH-)+C(CH3COOH)
 D.常温下,0.2mol/L的HA溶液与0.1mol/L的NaOH溶液等体积混合,混合液pH一定小于7。
D.常温下,0.2mol/L的HA溶液与0.1mol/L的NaOH溶液等体积混合,混合液pH一定小于7。
5. A元素原子最外层电子数为a,次外层电子数为b;B元素的原子M层电子数为a-b,L层电子数为a+b;则对AB两元素形成的化合物晶体叙述正确的是( )
A元素原子最外层电子数为a,次外层电子数为b;B元素的原子M层电子数为a-b,L层电子数为a+b;则对AB两元素形成的化合物晶体叙述正确的是( )
 A.分子晶体,是一种弱电解质 B.离子晶体,是一种强电解质
A.分子晶体,是一种弱电解质 B.离子晶体,是一种强电解质
 C.是一种合金
D.原子晶体,是一种非电解质
C.是一种合金
D.原子晶体,是一种非电解质
4.某金属氧化物在光照下可生成具有很强氧化能力的物质,能用来消除空气和水体中的污染物,下列有关该金属氧化物的应用叙述不正确的是( )
A.将形成酸雨的SO2氧化成SO3
B.将装修家居释放出来的甲醛氧化成CO2和水
C.将医药废水中的苯酚氧化成C O2及水
D.将电镀废水中的氰根(CN一)氧化成C O2及N2
3.已知25℃、101kpa条件下:
(1)4AI(s)+302(g)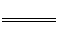
 2A1203(s);△H=-2834.9kJ·mol-1
2A1203(s);△H=-2834.9kJ·mol-1
(2)4A1(s)+203(g)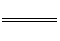
 2Al2O3(s);△H
=-3119.1KJ·mol-1
2Al2O3(s);△H
=-3119.1KJ·mol-1
由此得出的结论正确的是( )
A.3mol氧气生成2mol臭氧放出的热量284.2kJ
B.等质量的O2比O3的能量高
C.O3比O2稳定,由O2变为O3的化学反应为放热反应
D.O2比O3稳定,由O2变为O3的化学反应为吸热反应
2.下列叙述正确的是( )
A.在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原
B.元素由化合态变成游离态时,它可能被氧化,也可能被还原
C.失电子难的原子,获得电子的能力一定强
D.有单质参加或生成的反应一定属于氧化还原反应
1.2008年诺贝尔化学奖获得者之一钱永健在发现研究绿色莹光蛋白(GFP)如何发光等作出了突出贡献。下列对GFP等的叙述合理的是( )
A.GFP在硫酸铜或饱和硫酸铵溶液中发生盐析,盐析是可逆过程
B.GFP在酸、碱、酶作用下发生水解,水解的最终产物氨基酸只能与碱反应
C.GFP在乙醇等作用下会凝结、变性,变性为不可逆过程
D.GFP与水的液态混合物可用盐析法分离,盐析法为化学方法
44、(10分)(写对7个给10分;写对6个给8分;写对5 个给7分;写对4个给6分;写对3个 给5分;写对2个给4分;写对1 个给1分;但第一个必须是所给答案,第二个可以放至第六步,其余依次往前推,不必写出反应条件。如有综合24题所给条件写六步也可得全分,即将第五步和第六步合一步。)
从石油化工产品中任选一种三个碳的烃为唯一碳源和有关物质为原料合成
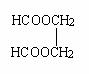
二甲酸乙二酯,( )写出各步反应的化学方程式。(可不注明反应条件)
已知:

(R1、R2、 R3、R4、可代表烃基,也可代表氢原子)
⑴ 。
⑵ 。
⑶ 。
⑷ 。
⑸ 。
⑹ 。
⑺ 。
|

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com