
题目列表(包括答案和解析)
4、人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力,CO吸入肺中发生反应:CO+HbO2 O2+HbCO ,37 ℃时,该反应的平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是( )
O2+HbCO ,37 ℃时,该反应的平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是( )
A.CO与HbO2反应的平衡常数K=
B.人体吸入的CO越多,与血红蛋白结合的O2越少
C.当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损
D.把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动
3.下列化学用语正确的是( )
A.表示乙炔“燃烧热”对应的热化学方程式:
C2H2(g)+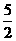 O2(g) = 2CO2(g)+H2O(g);△H =-1 256 KJ/mol
O2(g) = 2CO2(g)+H2O(g);△H =-1 256 KJ/mol
B.Na2O2的电子式:
C.电解氢氧化钠溶液铁作电极阳极的电极反应式为:Fe-3e-+3OH-=Fe(OH)3
D.表示中和热的热化学方程式:NaOH(aq)+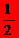 H2SO4(aq)=
H2SO4(aq)= 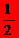 Na2SO4(aq)+H2O(l)
;
Na2SO4(aq)+H2O(l)
;
△H = -57.3kJ/mol
2、在密闭容器里,A与B反应生成C,其反应速率分别用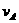 、
、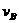 、
、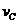 表示,已知2
表示,已知2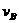 =3
=3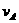 、3
、3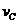 =2
=2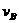 ,则此反应可表示为( )
,则此反应可表示为( )
A.2A+3B=2C B.A+3B=2C C.3A+B=2C D.A+B=C
1、已知反应X+Y= M+N为放热反应,,对该反应的下列说法中正确的( )
A.X的能量一定高于M
B.Y的能量一定高于N
C.X和Y的总能量一定高于M和N的总能量
D.因该反应为放热反应,故不必加热就可发生
24.(10分)通常情况下空气中CO2的体积分数为0.030%,当空气中CO2的体积分数超过0.050%时,会引起明显的温室效应。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
(1)目前,用超临界CO2(其状态介于气态和液态之间)代替氟利昂作致冷剂已成为一种趋势,这一做法对环境的积极意义在于_______________________________。
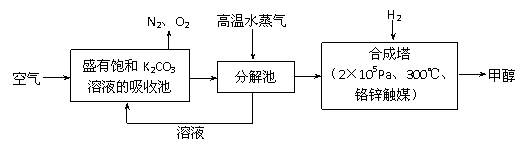 (2)最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下:
(2)最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下:
①吸收池中反应的化学方程式为_____________________________________。
②在合成塔中,若有4.4kg CO2与足量H2恰好完全反应,可放出4947 kJ的热量,试写出合成塔中发生反应的热化学方程式________________________________。
(3)小李同学拟用沉淀法测定空气中CO2的体积分数,他查得CaCO3、BaCO3的溶度积(Ksp)分别为4.96×10-9、2.58×10-9。
小李应该选用的试剂是___________________,实验时测定的数据除空气的体积外,还需要测定____________________________________________________________。
福建省福州三中2010届高三上学期第三次月考
23.(15分)化学兴趣小组设计以下实验方案,测定某已部分变质的小苏打样品中Na2CO3的质量分数。
[方案一]
称取一定质量样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算。
(1)坩埚中发生反应的化学方程式为: ;
(2)实验中,需加热至恒重的目的是 。
[方案二]
称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量Ba(OH)2溶液,过滤,洗涤、干燥沉淀,称量固体质量,计算。(已知:Ba2++OH-+HCO3-==BaCO3↓+H2O)
(1)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为 。
(2)实验中判断沉淀是否完全的方法是 。
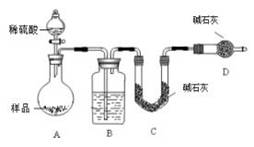 [方案三]
[方案三]
按如下图所示装置进行实验:
(1)检查装置A的气密性的方法是
___________________________
___________________________
(2)D装置的作用是
。
分液漏斗中 (填“能”或“不能”)用盐酸代替稀硫酸进行实验。
(3)实验前称取17.90g样品,实验后测得C装置增重8.80g,则样品中Na2CO3的质量分数为 。
(4)根据此实验测得的数据,测定结果有误差,因为实验装置还存在一个明显缺陷是:
_________________________________________________。
22.(12分).在容积为2L的密闭容器中,进行如下反应:
A(g)+2B(g)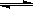 C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题:
C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题:

(1)800℃时。0-5min内,以B表示的平均反应速率为 。
(2)能判断该反应达到化学平衡状态的依据是 。
A.容器压强不变 B.混合气体中c(A)不变
C.2v正(B)=v逆(D) D.c(A)=c(C)
E.混合气体密度不变
(3)若最初加入1.0molA和2.2molB,利用图中数据计算800℃时的平衡常数K= ,B的平衡转化率为: 。该反应为 反应(填吸热或放热)
(4)700℃时,某时刻测得体系中各物质的量如下:n(A)=2.2mol,n(B)=5.2mol,n(C)=1.8mol,n(D)=1.8mol,则此时该反应 进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
21.(13分)四种短周期元素A、B、C、D原子序数依次增大。A、B、C三种元素原子核外电子层数之和是5。A、B两种元素原子最外层电子数之和等于C元素原子最外电子层上的电子数;B元素原子最外电子层上的电子数是它电子层数的2倍,A和C可以形成化合物CA3,B与D的原子序数之比为3∶4。请回答:
(1)化合物CA3的化学式是 。
(2)写出A和C化合生成CA3反应的平衡常数表达式 。在一定条件下要使该反应平衡向右移动,可采取的措施有 。
A.缩小反应容器容积 B.增大反应容器容积
C.使用合适的催化剂 D.及时分离出生成物
(3)由四种元素中的三种元素组成的物质甲属于盐类,其水溶液呈酸性,请用离子方程式表示其呈酸性的原因 ,若用pH试纸测定0.1 mol/L的甲溶液的pH,实验操作是 。
(4)乙和丙为含有上述四种元素的常见无机盐,二者均既可与盐酸又可与烧碱溶液反应。则乙和丙的化学式为乙: ;丙 。
(5)写出乙溶液与硫酸氢钠溶液反应的离子方程式_______________________________.
20.氢氧化镁是重要的绿色阻燃剂,氢氧化镁中含有少量氢氧化铁杂质,为研究不同分离提纯条件下所制得阻燃剂的纯度从而确定最佳生产条件,某研究小组各取等质量的下列4组条件下制得的阻燃剂进行含铁量的测定,实验结果如下:
|
精制Mg(OH)2的条件 |
阻燃剂铁含量 |
|||
|
序号 |
分离体系温度T/℃ |
加入EDTA质量(g) |
加入保险粉质量(g) |
W(Fe)/(10-
4g) |
|
1 |
40 |
0.05 |
0.05 |
7.63 |
|
2 |
40 |
0.05 |
0.10 |
6.83 |
|
3 |
60 |
0.05 |
0.10 |
6.83 |
|
4 |
60 |
0.10 |
0.10 |
6.51 |
若不考虑其它条件,根据上表数据,制取高纯度阻燃剂最佳条件是 ( )
① 40℃ ② 60℃ ③EDTA质量为 0.05g
④EDTA质量为 0.10g ⑤保险粉质量为 0.05g
⑥保险粉质量为 0.10g
A.①③⑤ B.②④⑥ C.①④⑥ D.②③⑤
第Ⅱ卷(共50分)
19.在碱性锌锰干电池中,已知氢氧化钾为电解质,发生的电池总反应为
Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2
下列该电池的电极反应正确的是 ( )
A.负极反应为Zn-2e-=Zn2+
B.负极反应为Zn+2H2O-2e-= Zn(OH)2+H+
C.正极反应为2MnO2+2H++ 2e-=2MnOOH
D.正极反应为2MnO2+2H2O + 2e-=2MnOOH+2OH-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com