
题目列表(包括答案和解析)
19. 将0.2 mol/L HCN溶液和0.1 mol/L的NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的是 ( )
A.c(HCN)<c(CN-) B.c(Na+)>c(CN-)
C.c(HCN)-c(CN-)=c(OH-) D.c(HCN)+c(CN-)= c(Na+)
18.用铅蓄电池电解苦卤水(含C1-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极)。下列说法中正确的是 ( )
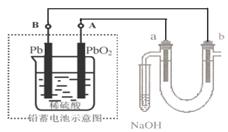 A.铅蓄电池负极的反应式为:Pb -2e-
=== Pb2+
A.铅蓄电池负极的反应式为:Pb -2e-
=== Pb2+
B.铅蓄电池放电时,B极质量减轻,A极质量增加
C.铅蓄电池充电时,A极应与外电源负极相连
D.电解苦卤水时,a 电极首先放电的是Br-
17.实验是化学研究的基础,关于下列各装置图的叙述中,正确的是 ( )


A.装置①是一套实验室制气装置,用于发生、干燥和收集气体,如铜屑与稀硝酸
B.装置②中,a为正极,d为阳极
C.装置③可用于收集H2、NH3、Cl2、HCl、NO2等
D.装置④能用于测量气体体积的装置
16. 离子在一定条件下可把Mn2+氧化成
离子在一定条件下可把Mn2+氧化成 ,若反应后
,若反应后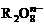 变成
变成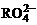 ,又知反应中氧化剂与还原剂的离子个数比为5:2,则
,又知反应中氧化剂与还原剂的离子个数比为5:2,则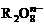 中R元素的化合价以及n分别为
中R元素的化合价以及n分别为
( )
A. +7,2 B. +6 ,2 C. +5,1 D. +4,1
15. 下列各溶液中,微粒的物质的量浓度关系正确的是 ( )
A.室温下,由pH=1的CH3COOH溶液与pH=13的NaOH溶液等体积混合,浓度大小的顺序为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.由10mL 0.1mol/L的CH3COOH溶液与10mL0.1mol/L的NaOH溶液混合, 浓度大小的顺序为:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
C.常温下,0.1mol/LpH=8的NaHB溶液中:c(HB-)>c(B2-)>c(H2B)
D.常温下,在pH=8的NaA溶液中:c(Na+)-c(A-)=9.9 ×10-7mol/L
14.能正确表示下列反应的离子方程式是 ( )
A.偏铝酸钠溶液中加入过量盐酸:AlO2- + 4 H + = Al3+ + 2 H2O
B.向氯化亚铁溶液中通入氯气:Fe2+ + Cl2 = Fe3+ + 2 Cl -
C.硫化钠水解:S2-+ 2 H2O = H2S ↑ + 2 OH -
D.铜片跟稀硝酸反应:Cu + NO3- + 4 H+ = Cu2+ + NO↑ + 2 H2O
13.下列各组离子中能够大量共存的是 ( )
① 中性溶液中:Mg2+、Fe3+、SO4 2 - 、F-
② PH=0的溶液中:Al3+、NH4+、Ca2+、Cl - 、NO3-
③ c(H+)= 10 -14 mol·L-1 溶液中:Na+、AlO2-、SO32 -、S2-
④ PH = 1的溶液中:Fe2+、Na+、SO42-、NO3-
A.①④ B. ①③ C. ②③ D ②④
12. 某些金属卤化物可以跟其卤素反应,如KI+I2 KI3,则下列推断错误的是 ( )
某些金属卤化物可以跟其卤素反应,如KI+I2 KI3,则下列推断错误的是 ( )
A. 在KI3溶液中加入淀粉溶液可变蓝色
 B.I
B.I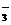 在溶液中存在如下平衡:I
在溶液中存在如下平衡:I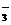 I2+I-,向溶液中滴加AgNO3溶液时,会出现黄色沉淀
I2+I-,向溶液中滴加AgNO3溶液时,会出现黄色沉淀
C.配制碘水时加入KI可以增大I2在水中的溶解程度
D.将氯气通入KI3液中,I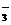 的浓度不会发生变化
的浓度不会发生变化
11.下列关于离子共存的说法不正确的是 ( )
A.在溶液中K+、Fe3+、Cl-、S2-是因发生氧化还原反应而不能大量共存
B.在c(H+)=10-13mol/L的溶液中K+、Cl-、AlO2-、CO32-能大量共存,且加入NaHSO4溶液过程中会产生气体和沉淀
C.某透明溶液中可以存在Cu2+、NO3-、H+、SO42-
D.某溶液中加入金属铝有H2放出,则溶液中一定能大量共存K+、Mg2+、NO3-、SO42-
10.在200 mL含Mg2+、Al3+、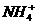 、H+、
、H+、 等离子的溶液中,逐滴加入5mol•L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示。下列叙述不正确的是 ( )
等离子的溶液中,逐滴加入5mol•L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示。下列叙述不正确的是 ( )
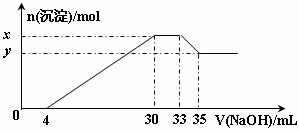
A.x与y的差值为0.01 mol B.原溶液中c( )=0.75 mol·L-1
)=0.75 mol·L-1
C.原溶液的pH=1 D.原溶液中n(Mg2+)∶n(Al3+)=5∶1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com