
题目列表(包括答案和解析)
6. 下列各组物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入前者,反应现象都相同的是
A AgNO3和氨水 B AlCl3和NaOH
C NaAlO2和H2SO4 D Ba(HCO3)2和Ba(OH)2
5. 下列实验设计和结论相符的是
A.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
B.某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性
C.某无色溶液中加Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO42-
D.在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到较纯净的FeCl3溶液复原色
4. 碱金属与卤素所形成的化合物大都具有的性质是
① 高沸点 ② 能溶于水 ③ 水溶液能导电 ④ 低熔点 ⑤ 熔融状态不导电
A ①②③ B ③④⑤ C ①④⑤ D ②③⑤
3. 能正确表示下列反应的离子方程式是
A. 向次氯酸钙溶液通入过量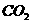 :
:
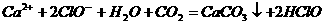
B. 向次氯酸钙溶液通入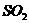 :
:
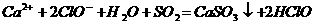
C. 氢氧化钙溶液与碳酸氢镁溶液反应:
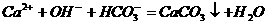
D. 在氯化亚铁溶液中加入稀硝酸:
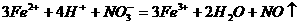
2. 下列离子在溶液中因发生氧化还原反应而不能大量共存的是
A Ag+、NO3-、Cl-、K+ B H3O+、NO3-、Fe2+、Na+
C K+、Ba2+、OH-、SO42- D Cu2+、NH4+、Br-、OH-
1. 下列关于氯的说法正确的是
A.Cl2具有很强的氧化性,在化学反应中只能作氧化剂
B.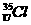 、
、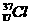 为不同的核素,有不同的化学性质
为不同的核素,有不同的化学性质
C.实验室制备Cl2,可用排饱和食盐水集气法收集
D.1.12LCl2含有1.7NA个质子(NA 表示阿伏伽德罗常数)高考
33.(4分)难溶电解质在水溶液中存在电离平衡。在常温下FeS的溶度积Ksp=6.25×10-18, 则该温度下,FeS的溶解度是多少?
又知常温下H2S饱和溶液中c(H+)与c(S2-)间存在以下关系:c2(H+)×c(S2-)= 1.0×10-22.在该温度下,将适量的FeS 投入H2S饱和溶液中欲使溶液中,
若使c(Fe2+)达到1mol/L,应调节溶液的pH值为多少?
32.(6分)在25℃时,将0.05mol/L的盐酸与未知浓度的NaOH溶液以1∶2的体积比混合,所得溶液pH值为2。用上述NaOH溶液与某一元弱酸HA 20.0 mL反应,恰好中和时消耗NaOH溶液10.0 mL,所得溶液pH值为10.
(1)c(NaOH) =
(2)c(HA) =
(3)盐类水解程度的大小可用“水解度(h)”来表示。对于NaA型盐的水解度(h)表示为:(已水解的物质的量/原来总物质的量)×100%。则上述所得NaA溶液的水解度(h)为 (写出必要的计算过程)
31.( 11 分)有常见A、B、C三种短周期元素,它们的原子序数依次增大,B元素原子最外层电子数是C元素原子最外层电子数的一半,A元素原子最外层电子数比B元素原子最外层电子数多一个。甲、乙、丙是三种含氧酸的钠盐,甲中含B元素,乙中含C元素,丙中含A元素,甲、丙溶液pH>7,乙溶液pH<7;丁为气体,戊为淡黄色固体。甲、乙、丙、丁、戊、己六种物质之间的相互反应关系如图:
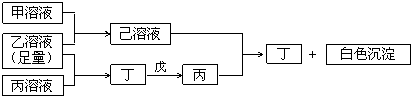
(1)写出C元素的原子结构示意图 ,写出丁和戊的电子式________、________;
(2)用有关化学反应方程式解释:
乙溶液呈酸性的原因: ;
丙溶液呈碱性的原因: ;
(3)写出有关反应的离子方程式:
①乙溶液+丙溶液→丁: ;
②己溶液+丙溶液→丁: .
30.(2分)用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是:
A.配制标准溶液的NaOH中混有KOH杂质
B.滴定终点读数时,俯视滴定管的刻度,其他操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E.未用标准液润洗碱式滴定管
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com