
题目列表(包括答案和解析)
25.(7分)常温下①0.2mol/L NaOH溶液、 ②0.2mol/L
HX溶液,两溶液等体积混合后,测得溶液中c(Na+)> c(X-)。则:

(1)①中由水电离出的c(H+)= mol/L

(2)①中由水电离出的c(H+) ②中由水电离出的c(H+)(填“>”、“=”或“<”)

(3)上述混合溶液中共存在 种粒子,

c(HX) c(X-)(填“>”、“=”或“<”)

c(HX)+c(X-)= mol/L(忽略体积变化)

(4)上述混合溶液显
性(填“酸”、“碱”或“中”),

其原因用离子方程式表示 

24.(12分)如图,有甲、乙两容器,甲体积可变压强不变,乙保持体积不变。向两容器中分别充入1molA、3molB,此时两容器体积均为500mL,温度为T℃。保持温度不变发生反应A(g)+3B(g)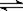 2C(g)+ D(s) △H<0,甲容器中反应2
min后达到平衡状态,且A的转化率为40%。
2C(g)+ D(s) △H<0,甲容器中反应2
min后达到平衡状态,且A的转化率为40%。

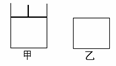






(1)下列能表明甲和乙两容器反应一定达到平衡状态的是


A.混合气体总质量不随时间改变 B.2v正(C)=3v逆(B) 

C.物质D的质量不随时间改变 D.A、B转化率相等


(2)乙容器中反应达到平衡所需要的时间 2min(填“>”、“<”或“=”,下同),B的转化率α乙(B) α甲(B)

(3)其它条件不变,甲中如果从逆反应方向开始反应建立平衡,要求平衡时C的物质的量与(1)中甲平衡时C的物质的量相等,则需要加入C的物质的量n(C) = mol,加入D的物质的量n (D)应该满足的条件为


23.用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。

 (1)合成氨反应反应N2(g)+3H2(g) 2NH3(g),恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(“向左”“向右”或“不”);,使用催化剂 反应的ΔH(“增大”“减小”或“不改变”)。
(1)合成氨反应反应N2(g)+3H2(g) 2NH3(g),恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(“向左”“向右”或“不”);,使用催化剂 反应的ΔH(“增大”“减小”或“不改变”)。

 (2)O2 (g)= O+2(g)+e-
(2)O2 (g)= O+2(g)+e-  H1=
+1175.7 kJ·mol-1
H1=
+1175.7 kJ·mol-1

 PtF6(g)+ e- PtF6-(g)
PtF6(g)+ e- PtF6-(g)  H2=
-771.1 kJ·mol-1
H2=
-771.1 kJ·mol-1

 O2+PtF6-(s)=O2+(g)+PtF6-
O2+PtF6-(s)=O2+(g)+PtF6-  H3=+482.2 kJ·mol-1
H3=+482.2 kJ·mol-1

 则反应O2(g)+ PtF6 (g)
= O2+PtF6- (s)的
则反应O2(g)+ PtF6 (g)
= O2+PtF6- (s)的 H=_______
kJ·mol-1。
H=_______
kJ·mol-1。

 (3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为___________________________________________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为___________________________________________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。

 (4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显____性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=______。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显____性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=______。

22.已知pH=2的高碘酸(H5IO6)溶液与pH=12的NaOH溶液等体积混合,所得溶液呈酸性; 0.01 mol·L-1的HIO3或HMnO4溶液与pH=12的Ba(OH)2溶液等体积混合所得溶液均呈中性,

(1)H5IO6是
(填“强电解质”或“弱电解质”)

(2)已知H5IO6和MnSO4在溶液中反应生成高锰酸、碘酸和硫酸,反应中氧化剂是
(填化学式),反应的离子方程式为



21.下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
族   周期 周期 |
IA |
|
0 |
|||||
|
1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
2 |
|
|
|
② |
③ |
④ |
|
|
|
3 |
⑤ |
|
⑥ |
⑦ |
|
|
⑧ |
|
(1)④、⑤、⑥的原子半径由大到小的顺序为____________________。

 (2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是_________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是_________。

 (3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:_______________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:_______________。

 (4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)_________________。
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)_________________。

 a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4

 (5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:


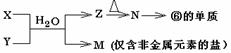


 X溶液与Y溶液反应的离子方程式为___________________________,
X溶液与Y溶液反应的离子方程式为___________________________,

 N→⑥的单质的化学方程式为_________________________________。
N→⑥的单质的化学方程式为_________________________________。

 常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至_________________。
常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至_________________。

20.反应A2+B2 2AB在不同温度和压强改变条件下,产物AB的生成情况,如右图所示:a为500℃,5.05×105Pa,b为300℃,5.05×105Pa时情况,c为300℃时从时间t3开始向容器中加压的情况,则下列叙述正确的是:
2AB在不同温度和压强改变条件下,产物AB的生成情况,如右图所示:a为500℃,5.05×105Pa,b为300℃,5.05×105Pa时情况,c为300℃时从时间t3开始向容器中加压的情况,则下列叙述正确的是: 

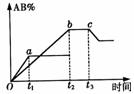 A.A2、B2、AB均为气体,正反应放热
A.A2、B2、AB均为气体,正反应放热

B.AB为气体,A2、B2中最少有一种为非气体,

正反应放热

C.AB为气体,A2、B2中最少有一种为非气体,

正反应吸热

D.AB为固体,A2、B2中最少有一种为非气体,

正反应吸热

第 Ⅱ 卷 (共60分)

19.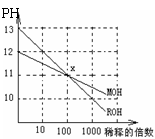 MOH和ROH两种一元碱的溶液分别加水稀释时,PH变化如右图所示。下列叙述中正确的是
MOH和ROH两种一元碱的溶液分别加水稀释时,PH变化如右图所示。下列叙述中正确的是

A.MOH和ROH都是强碱 

B.稀释前,c(ROH)=10c(MOH)

C.常温下pH之和为14的醋酸和ROH

溶液等体积混合,所得溶液呈碱性

D.在x点,c(M+)=c(R+)



18.
 在一定条件下,Na2CO3溶液存在水解平衡:
。下列说法正确的是
在一定条件下,Na2CO3溶液存在水解平衡:
。下列说法正确的是

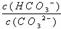
 A. 稀释溶液,水解平衡常数增大 B. 通入CO2,平衡朝正反应方向移动
A. 稀释溶液,水解平衡常数增大 B. 通入CO2,平衡朝正反应方向移动

 C. 升高温度,
减小 D. 加入NaOH固体,溶液PH减小
C. 升高温度,
减小 D. 加入NaOH固体,溶液PH减小

17.室温时0.1mo1/L某酸HA在水中有0.1%发生电离,下列叙述错误的是:

 A.HA电离出的c(H+)约为水电离出的c(H+)的106倍 B.该溶液的pH= 4
A.HA电离出的c(H+)约为水电离出的c(H+)的106倍 B.该溶液的pH= 4

 C.升高温度,溶液的pH增大
C.升高温度,溶液的pH增大 D.此酸的电离平衡常数约为1×10-7
D.此酸的电离平衡常数约为1×10-7

16.为除去氯化钙溶液中的Fe3+离子,可在加热搅拌下加入的试剂是

A.铁 B.氢氧化钠 C.碳酸钠 D.碳酸钙

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com