
题目列表(包括答案和解析)
9.下列反应的离子方程式正确的是( )
A.钠与水的反应:Na+H2O=Na++OH-+H2↑
B.氯气与水反应:Cl2+H2O=2H++Cl-+ClO-
C.氢氧化铝中和胃酸:Al(OH)3+3H+=Al3++3H2O
D.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+
8.根据下列反应判断有关物质还原性由强到弱的顺序是 ( )
①H2SO3 + I2 + H2O = 2HI + H2SO4
②2FeCl3 + 2HI = 2FeCl2 + 2HCl + I2
③3FeCl2 + 4HNO3 = 2FeCl3 + NO↑ + 2H2O + Fe(NO3)3
A.H2SO3>I->Fe2+>NO B.I->Fe2+>H2SO3>NO
C.Fe2+>I->H2SO3>NO D.NO>Fe2+>H2SO3>I-
7.在给定的四种溶液中,同时加入以下各种离子,可能在该溶液中大量共存的是( )
A.pH为1的溶液:Ca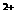 、Na
、Na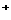 、Mg
、Mg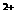 、NO3
、NO3
B.滴加石蕊试液显红色的溶液:Fe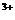 、NH4
、NH4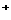 、Cl
、Cl 、SCN
、SCN
C.与铝反应放出氢气的溶液:K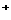 、HCO3
、HCO3 、Br
、Br 、Ba
、Ba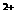
D.所含溶质为FeCl2的溶液:K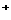 、SO4
、SO4 、NO3
、NO3 、H
、H
6.77777在3S + 6KOH = 2K2S + K2SO3 + 3H2O反应中,作氧化剂的S原子与作还原剂的S原子的物质的量之比是
A.1∶2 B.2∶1 C.1∶3 D.3∶1
5. 右图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此,下列说法正确的是( )
右图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此,下列说法正确的是( )
A. 该硫酸的物质的量浓度为9.2 mol·L-1
B. 1mol Zn 与足量的该硫酸反应产生2g H2
C. 配制200mL 4.6 mol·L-1的稀硫酸需取该硫酸50mL
D. 该硫酸与等体积的水混合后所得溶液的
物质的量浓度等于9.2 mol·L-1
4.下列化学方程式中,不能用离子方程式 Ba2+ +SO42―====BaSO4↓表示的是 ( )
A.Ba(NO3)2+H2SO4==BaSO4↓+2HNO3
B.BaCl2+Na2SO4==BaSO4↓+2NaCl
C.BaCO3+H2SO4==BaSO4↓+H2O+CO2↑
D.BaCl2+H2SO4==BaSO4↓+2HCl
3. 根据下列反应,推断盐酸应当具有的性质是( )
①Zn+2HCl=ZnCl2+H2↑ ②2HCl+CuO=CuCl2+H2O
③MnO2+4HCl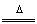 MnCl2+Cl2↑+H2O
MnCl2+Cl2↑+H2O
A.只有酸性 B.只有氧化性
C.只有还原性 D.有酸性、有氧化性和还原性
2.人体血红蛋白中含有 Fe2+离子,如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使Fe2+离子转变成Fe3+离子,生成高铁血红蛋白而丧失与 O2 结合的能力。服用维生素 c 可缓解亚硝酸盐的中毒,这说明维生素 C 具有( )
A 酸性 B 碱性 C氧化性 D还原性
1.在0.5L某浓度的NaC1溶液中含有0.5mol Na+,下列对该溶液的说法中,不正确的是( )
A.该溶液的物质的量浓度为1mol·L-1
B.该溶液中含有58.5g NaC1
C.配制100mL该溶液需用5.85g NaC1
D.量取100mL该溶液倒入烧杯中,烧杯中Cl 的物质的量为0.1mol
的物质的量为0.1mol
26.(7分)测定海水中溶解氧的步骤如下:

①水样的固定:取a mL海水样迅速加入固定剂MnSO4溶液和碱性KI溶液(含KOH),立即塞好塞子,并振荡均匀,使之充分反应.

②酸化:开塞后迅速加适量1∶1硫酸,再迅速塞好塞子,反复振荡至沉淀完全溶解.

③滴定:向溶液中加入1 mL 0.5%淀粉溶液,再用bmol/L的Na2S2O3标准溶液滴定,有关的离子反应如下:




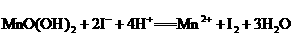


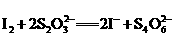


请回答下列问题:

(1)在进行①、②操作时,要注意“迅速”,如果操作缓慢,会使测定结果________________(填偏高、偏低或无影响,下同) 

(2)滴定前,用蒸馏水洗净滴定管即加入Na2S2O3标准溶液,会使测定结果____________ 

(3)滴定前,未排除滴定管中的气泡,在滴定过程中气泡排除,会使测定结果___________

(4)滴定终点时,溶液颜色变化是 _______ 

(5)滴定消耗了V ml Na2S2O3溶液,水中溶解O2(g/L)量的计算式为







湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com