
题目列表(包括答案和解析)
9.某学生的实验报告中有下列数据,其中合理的有 ( )
A.用托盘天平称取11.7g氯化钠
B.用50mL的量筒量取21.48mL盐酸
C.用100mL的容量瓶可配制80mL1mol/L的NaOH溶液
D.用pH试纸测定H2SO4溶液的pH为3.2
8.下图是A、B两种盐的溶解度随温度变化的曲线,下列有关说法正确的是( )
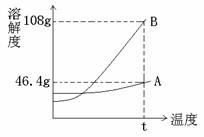
A.若A中混有少量的B,可采用冷却热饱和溶液法提纯A
B.上述两种盐在相同温度下配制的饱和溶液的浓度不可能相同
C.两种盐的饱和溶液A的浓度一定比B小
D.若B中混有少量的A,可采用冷却热饱和溶液法提纯B
7.(2007全国卷广东考题17)短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的3倍。下列说法正确的是 ( )
A.X的氢化物溶于水显酸性
B.Y位于周期表的第三周期IVA族
C.Z的单质易溶于二硫化碳中
D.X和Z的最高价氧化物对应的水化物都是弱酸
6.元素X、Y和Z可结合形成化合物XYZ3;X、Y和Z的原子序数之和为26;Y和Z在同一周期。下列有关推测正确的是
A.XYZ3是一种可溶于水的酸,且X与Y可形成共价化合物XY
B.XYZ3是一种微溶于水的盐,且X与Z可形成离子化合物XZ
C.XYZ3是一种易溶于水的盐,且Y与Z可形成离子化合物YZ
D.XYZ3是一种离子化合物,且Y与Z可形成离子化合物YZ3
5.下列各组气体或溶液用括号内试剂加以鉴别,其中不合理的是 ( )
A.二氧化碳、二氧化硫、一氧化碳(品红试液)
B.氯化钠、硝酸银、碳酸钠(稀盐酸)
C.酒精、醋酸、醋酸钠(石蕊试液)
D.硫酸、硝酸钡、氯化钾(碳酸钠溶液)
4.下列除去杂质的方法,正确的是 ( )
A.除去N2中的少量O2:通过灼热的CuO粉末,收集气体
B.除去CO2中的少量HCl:通入Na2CO3溶液,收集气体
C.除去FeCl2溶液中的少量FeCl3:加入足量铁屑,充分反应后,过滤
D.除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤
3.检验某未知溶液中是否含有SO42-,下列操作合理的是
A.加入硝酸酸化的硝酸钡溶液 B.先加硝酸酸化,再加硝酸钡溶液
C.先加盐酸酸化,再加氯化钡溶液 D.加入硫酸酸化的氯化钡溶液
2.(2007全国卷宁夏考题9)下列叙述错误的是 ( )
A.13C和14C属于同一种元素,它们互为同位素
B.1H和2H是不同的核素,它们的质子数相等
C.14C和14N的质量数相等,它们的中子数不等
D.6Li和7Li的电子数相等,中子数也相等
1.下列说法正确的是( )
A.电解强酸强碱的水溶液时阳极上产生的都是氧气
B.发生有效碰撞的分子一定是活化分子
C.放热反应都需要加热
D.正极上产生的气体不一定是氢气
20、(20分)实验室用密度为1.18g/mL,质量分数为36.5%浓盐酸配制250mL0.1mol/L的盐酸溶液,填空并请回答下列问题:
(1)配制250mL0.1mol/L的盐酸溶液。 应量取盐酸体积________mL ,应选用容量瓶的规格________mL。 除容量瓶外还需要的其它仪器___________________________。
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)________________
A.用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.用量筒量准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1-2cm处
(3) 操作A中,将洗涤液都移入容量瓶,其目的是_______________________________。
溶液注入容量瓶前需恢复到室温,这是因为__________________________________。
(4)若出现如下情况,对所配溶液浓度将有何影响(偏高、偏低或无影响)?
a.没有进行A操作___________ ; b.加蒸馏水时不慎超过了刻度______________ ;
c.定容时俯视________________。
(5)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度 ?__________________
21(12分)(1)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3e- → NO+2 H2O
在下列四种物质KMnO4、Na2CO3、KI、Fe2(SO4)3中的一种物质(甲)中滴加少量稀硝酸能使上述还原过程发生。
① 写出并配平该氧化还原反应的方程式, 用双线桥标出电子转移的方向和数目
②被还原的元素______,还原剂是 。
③反应生成0.3mol H2O,则转移电子的数目为 个。
(2)向 溶液中,逐滴加入
溶液中,逐滴加入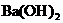 溶液至中性,写出发生反应的离子方程式:___________________________
_________.
溶液至中性,写出发生反应的离子方程式:___________________________
_________.
在以上中性溶液中,继续滴加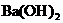 溶液,写出此步反应的离子方程式:
溶液,写出此步反应的离子方程式:
________________________________________.
22(4分)(1)向25mL 2mol·L-1稀硫酸中加入25mL 1mol·L-1的BaCl2溶液,充分反应后,溶液中H+物质的量浓度为(设稀溶液相混后总体积为原分体积之和) mol/L
(2)质量分数为a的某物质的溶液m g与质量分数为b的该物质的溶液n g混合后,蒸发掉p g水.得到的溶液每毫升质量为q g,物质的量浓度为c.则溶质的相对分子质量为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com