
题目列表(包括答案和解析)
19.(石景山一模)一定条件下,用甲烷可以消除氮氧化物(NOx)的污染。已知:
① CH4 (g)+4NO2 (g)=4NO (g) +CO2 (g)+2H2O (g) ;△H=―574 kJ·mol-1
② CH4 (g)+4NO (g)=2N2 (g)+CO2 (g)+2H2O (g) ;△H=―1160 kJ·mol一1。
下列选项正确的是
A.CH4 (g)+2NO2 (g)= N2 (g)+CO2 (g)+2H2O (l) ;△H=―867 kJ·mol-1
B.若0.2 mol CH4还原NO2至N2,在上述条件下放出的热量为173.4 kJ
C.CH4催化还原NOx为N2的过程中,若x=1.6,则转移的电子为3.2 mol
D.若用标准状况下2.24L CH4还原NO2至N2,整个过程中转移的电子为1.6 mol
18.(海淀一模)下图装置(Ⅰ)是一种可充电电池的示意图,装置(Ⅱ)为电解池的示意图。装置(Ⅰ)的离子交换膜只允许Na+ 通过。已知电池充、放电的化学反应方程式为2Na2S2+NaBr3 Na2S4+3NaBr。当闭合开关K时,X极附近溶液变红色。下列说法正确的是
Na2S4+3NaBr。当闭合开关K时,X极附近溶液变红色。下列说法正确的是
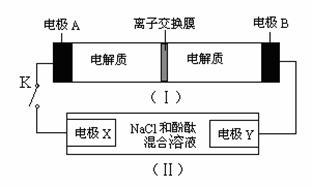
A.闭合K时,钠离子从右到左通过离子交换膜
B.闭合K时,负极反应为3NaBr-2e-=NaBr3+2Na+
C.闭合K时,X电极的电极反应式为2Cl- -2e- = Cl2↑
D.闭合K时,有0.1 mol Na+通过离子交换膜,X电极上析出标准状况下气体1.12 L
17.将质量为w1g的钠、铝混合物投入一定量的水中充分反应,金属没有剩余,共收集到标准状况下的气体V1L。向溶液中逐渐加入浓度为amol/L的HCl溶液,反应过程中先有白色沉淀生成后又逐渐溶解,当沉淀恰好消失时所加HCl溶液体积为V2L。将溶液蒸干灼烧得固体w2g.下列关系式中正确的是 ( )
①23n(Na)+27n(Al)=w1 ②n(Na)+3n(Al)=2V1/22.4 ③aV2= V1/22.4
④35.5aV2=w2-w1 ⑤35.5aV2>(w2-w1) ⑥35.5aV2<(w2-w1)
A. ①②④ B. ①②⑤ C. ①③⑥ D.①③④
16.(西城一模)某无色溶液中可能含有①Na+ ②Ba2 +③Cl一 ④Br一⑤SO32一⑥SO42一 离子中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下。
|
下列结论正确的是
A.肯定含有的离子是①④⑤ B.肯定没有的离子是②⑥
C.不能确定的离子是① D.不能确定的离子是③⑤
15.下列反应的离子方程式书写中,正确的是
A.硫酸亚铁酸性溶液置于空气中变质:4Fe2++O2+4H+=4Fe3++2H2O
B.少量稀 HNO3中加入足量铁粉:Fe+4H++NO3-=NO↑+Fe3++2H2O
C.铝片跟氢氧化钠溶液反应:Al+2OH-=AlO2-+H2↑
D.硫酸铝溶液中加入过量氨水:Al3++3OH-=Al(OH)3↓
14.(广东理科基础35).下列有关Cl、N、S等非金属元素化合物的说法正确的是
A.漂白粉的成分为次氯酸钙
B.实验室可用浓硫酸干燥氨气
C.实验室可用NaOH溶液处理NO2和HCl废气
D.Al2(SO4)3可除去碱性废水及酸性废水中的悬浮颗粒
13.下列实验操作合理的是 ( )
①将干燥的pH试纸浸到某溶液中,过一会取出与标准比色卡比较,测得该溶液的pH;
②用铂丝蘸取某溶液在酒精灯外焰上灼烧,直接观察火焰颜色来确认是否含有钾元素;
③通过丁达尔现象来区别硫酸铜溶液和氢氧化铁胶体;
④配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸;
⑤检验红砖中的氧化铁成分时,向红砖粉末中加入盐酸,放置至充分沉淀后,取上层清液于试管中,滴加KSCN溶液即可。
A.③⑥ B.②③ C.③④⑥ D.①③④
12.两种微粒含有相同的质子数和电子数,这两种微粒的关系可能是:(1)同一元素的不同原子,(2)不同元素的原子,(3)两种不同的分子(4)一种原子和一种分子,(5)一种原子和一种离子,(6)一种分子和一种离子,(7)两种不同的阳离子,(8)两种不同的阴离子,(9)一种阴离子和一种阳离子,其中正确的是 ( )
A.(1)(3)(4)(7)(8) B.(1)(2)(5)(7)(9)
C.(1)(2)(5)(7)(9) D.(1)(2)(3)(4)(5)
11.相同材质的铁在下列情形下最不易被腐蚀的是
A.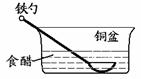 B.
B.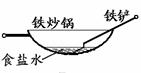

C.
 D.
D.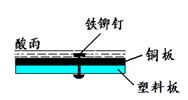

10.铝及铝合金经过阳极氧化,铝表面能生成几十微米的氧化铝膜。某研究性学习小组模拟工业法对铝片表面进行氧化处理,其装置如下图所示。现以铅为阴极,铝片为阳极,以硫酸溶液为电解液,按照右图连接电解装置,电解40min后取出铝片,用水冲洗,在其表面即可得到致密的氧化膜。下列有关说法正确的是( )
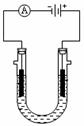
A.电解时电流从电源正极→导线→铝极,铅极→导线→电源负极
B.在电解过程中,H+向阳极移动,SO42-向阴极移动
C.电解过程中阳极周围的pH明显增大
D.电解的总方程式可表示为2Al +3H2
S O4  2 Al2(S O4)3+3H2↑
2 Al2(S O4)3+3H2↑
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com