
题目列表(包括答案和解析)
29.SO2被空气氧化生成SO3是个放热的可逆反应。实验室根据该反应设计如图所示实验装置来制备SO3固体。请完成下列问题:
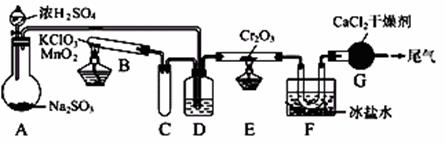
(1)实验前,必须进行的操作是(填操作名称,不必写具体过程)____________
(2)在A装置中加入Na2SO3固体的同时,还需加几滴水,然后再滴加浓硫酸。加几滴水的作用是__________________________________________
(3)小试管C的作用是________________________________
(4)广口瓶D内盛的试剂是浓硫酸,装置D的三个作用是:
①______________________②_____________________③_____________________
(5)装置G的作用是__________________________________
28.已知A为酸式盐,B为某二价主族金属元素的化合物,常温常压下C、D、F、G、I均呈气态。等物质的量A、B与少量的水充分混合能恰好完全反应。图中反应条件(除高温外)均已略去。
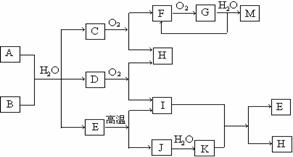
(1)写出B的电子式 ,D的结构简式 。
(2)写出A与B反应的化学方程式 。
(3)如对气体G进行加压操作,产生的现象是
(4)写出下列反应的离子方程式:
①在A溶液中加入M
②向A溶液中加入过量NaOH溶液,并加热
27.某待测溶液中可能含有Fe2+、Fe3+、Al3+、Ag+、Ba2+、NH4+、Ca2+等离子,进行以下实验(所加酸,碱,氨水,溴水都是过量的)

根据实验结果:
(1)断待测液中有无Ba2+、Ca2+,并写出理由。答
(2)写出沉淀D的化学式
(3)写出从溶液D生成沉淀E的反应离子方程式
26.已知A、B、C是常见的物质,以下是三种物质的转化关系。而且A+ C→B
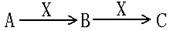
根据要求完成下列小题。
(1)若X是一种金属单质,试写出A+ C→B反应的离子方程式
(2)若X是一种强碱,试写出B+X→C反应的离子方程式
(3)若X是一种氧化物,试写出A+ C→B反应的离子方程式
25.相同体积的KI、Na2S、FeBr2溶液,分别通入足量的Cl2,当反应恰好完成时,消耗Cl2的体积相同(同温、同压条件下),则KI、Na2S、FeBr2溶液的物质的量浓度之比是
A.1:1:2 B.2:1:3 C.6:3:2 D.3:2:1
第 II 卷
24.(西城一模)为保障人体健康,必须严格限制用量的是
A.用SO2漂白食品 B.用小苏打制作糕点
C.用食醋清洗热水瓶胆内壁附着的水垢 D.用O3对游泳池中的水进行消毒
23.(东城一模)应用元素周期律分析下列推断,其中正确的组合是
①碱金属单质的熔点随原子序数的增大而降低
②砹(At)是第VIIA族,其氢化物的稳定性大于HCl
③硒(Se)的最高价氧化物对应水化物的酸性比硫酸弱
④第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性
⑤铊(Tl)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应
⑥第三周期金属元素的最高价氧化物对应水化物,其碱性随原子序数的增大而减弱
A.①③④ B.①③⑥ C.③④⑤ D.②④⑥
22.(崇文一模)将SO2通入由CuSO4和NaCl混合的浓溶液中,溶液颜色变浅,析出白色沉淀,取该沉淀进行元素质量分数分析,知其中含Cl:35.7%,Cu:64.3%,SO2在上述反应中的作用是
A.酸 B.漂白剂 C.还原剂 D.氧化剂
21.(石景山一模)用NA表示阿伏加德罗常数的值,下列说法中正确的是
A.标准状况下,2.24L的苯中含有0.3 NA个碳碳双键
B.常温常压下,0.2mol铁在0.2mol氯气中充分燃烧,转移的电子数为0.6 NA
C.工业用电解法进行粗铜精炼时,每转移1mol电子,阳极上溶解的铜原子数必为0.5NA
D.VLamoL/L的氯化铁溶液中,若Fe3+的数目为NA,则Cl-的数目大于3NA
20.(崇文一模)用下列实验装置进行的实验,能达到相应实验目的的是

A.装置甲:防止铁钉生锈 B.装置乙:除去乙烯中混有的乙炔
C.装置丙:验证HCl气体在水中的溶解性 D.装置丁:实验室制取乙酸乙酯
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com