
题目列表(包括答案和解析)
20、(6小问给分:2+2+3+3+1+2=13分)
有A、B、C、D、E、F、G、H、I九种常见物质,它们的转化关系(反应条件未注明)如图所示。其中B、C、D为单质,常温下D为固态,B、C、E、G为气态,F为淡黄色粉末,I的焰色反应为黄色。

请回答:
(1)写出F的电子式 ,其化学键类型有 。
(2)写出反应⑤的化学方程式 。
(3)I的是溶液呈 性(填酸性、中性或碱性),原因(用离子反应方程式表
示) 。
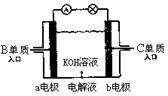 (4)B、C单质已被应用于字宙飞船的燃料电池
(4)B、C单质已被应用于字宙飞船的燃料电池
中,如右图所示,两个电极均由多孔性碳构成,
通入的两种单质由孔隙逸出并在电 极表面放电。
b是电池的 极;
a电极上的电极反应式是 。
(5)在①、②、③、④、⑤五个反应中,△H>0的反应是 (填序号)。
(6)在标准状况下,若将11.2L气体G通入350mL 2mol/L的H溶液中,反应后
溶液中离子浓度由大到小的顺序是
。
19、(10分)实验室可以通过三条途径来制取氮气:
①加热条件下用NH3还原CuO制得纯净的N2和活性铜粉,反应的化学方程式为:
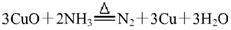
②将空气通过灼热的活性铜粉制得较纯净的N2
③加热NaNO2(有毒性)与NH4Cl的混合浓溶液制取N2,反应的化学方程式为:
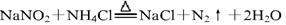
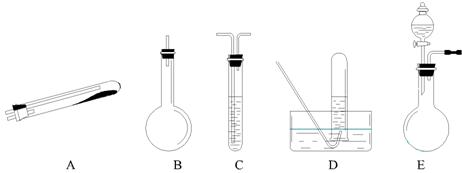 按上述途径制N2可供选择的实验仪器如下图所示,其他必要的仪器如铁架台、
按上述途径制N2可供选择的实验仪器如下图所示,其他必要的仪器如铁架台、
铁夹、铁圈、石棉网、酒精灯等未列出。
(1)按途径①制取N2时所需的氨气要用浓氨水与生石灰作原料制取,化学方程式为:
CaO+NH3·H2O===Ca(OH)2+NH3↑,最好要用上述仪器中的 (填仪器字母,
下同)作为氨气发生装置。要制取并收集纯净的N2(允许含少量的水蒸气),还应
使用到上述仪器中的 。
(2)①和②两种途径常常被协同使用。这种方法与途径 ③ 相比优点是
。
(3)检查 E 装置气密性的方法是 ,
。
利用 E 装置还可以制取的气体有 (写
出三种)。
18、将足量的CO2不断通入KOH、Ca(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2
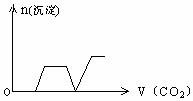
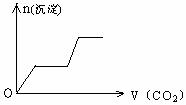 的量的关系可表示为-------------------------------------------------------------------------------[ ]
的量的关系可表示为-------------------------------------------------------------------------------[ ]
A B


C D
第二卷(非选择题 46分)
17、常温下,0.1 mol·L-1某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8,下列叙述正确
的是---------------------------------------------------------------------------------------------------[ ]
A.该溶液中水电离出的c(H+)=1×10-10 mol·L-1
B.该溶液中c(H+)+c(A-)+c(HA)=0.1 mol·L-1
C.该溶液与0.05 mol·L-1 NaOH溶液等体积混合后:c(A-)>c(Na+)>c(OH-)>c(H+)
D.向该溶液中加入一定量NaA晶体或加水稀释,溶液中c(OH-)均增大
16、常温下,在溶液中可发生以下反应:①16H +10Z
+10Z +2XO
+2XO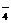 =2X
=2X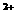 +5Z2 +8H2O,
+5Z2 +8H2O,
②2M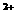 +R2=2M
+R2=2M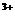 +2R-,③2R-+Z2=R2+2Z-,由此判断下列说法错误的是--[ ]
+2R-,③2R-+Z2=R2+2Z-,由此判断下列说法错误的是--[ ]
A.氧化性强弱顺序为: <Z2 <R2 <M
<Z2 <R2 <M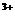
B.还原性强弱顺序为:X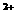 <Z
<Z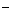 <R
<R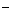 <M
<M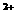
C.Z元素在反应①中被氧化,在③中被还原
D.常温下可发生反应2M2++Z2=2M3++2Z-
15、下列说法中正确的是------------------------------------------------------------------------------[ ]
A.同一周期元素的原子,半径越小越容易失去电子
B.在同一周期中,ⅠA族单质的熔点比ⅡA族的高
C.所有主族元素的最高化合价数与它的族序数数值相等
D.同主族元素的气态氢化物,相对分子质量越大,沸点不一定越高
14、短周期元素离子aW2+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确
的是----------------------------------------------------------------------------------------------------[ ]
A.质子数:c>b B.氢化物的稳定性:H2Y<HZ
C.离子的还原性:Y2-<Z- D.原子半径:r(X)<r(W)
13、下列有关比较,大小顺序排列错误的是-------------------------------------------------------[ ]
①热稳定性:PH3>H2S>HBr>NH3;
②碱性:KOH>Ca(OH)2>Mg(OH)2>Al(OH)3
③物质的熔点:石英>食盐>汞>硫;
④结合质子能力:OH->CO 32->CH3COO->SO42-
A.①② B.①③ C.②④ D.③④
12、物质氧化性、还原性的强弱,不仅与物质的结构有关,而且还与物质浓度、反应温
度等有关。下列各组物质:①Cu与HNO3溶液 ②Fe与FeCl3溶液 ③Zn与H2SO4
溶液 ④Fe与HCl溶液,由于浓度不同而发生不同氧化还原反应的是----------------[ ]
A.①③ B.②④ C.②③ D.③④
11、三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2。其反应原理为:
C3N3(OH)3  3HNCO; 8HNCO+6NO2
3HNCO; 8HNCO+6NO2  7N2+8CO2+4H2O
7N2+8CO2+4H2O
下列说法正确的是----------------------------------------------------------------------------------[ ]
A.C3N3(OH)3与HNCO为同一物质 B.反应中NO2是还原剂,HNCO是氧化剂
C.6mol NO2在反应中转移电子24mol
D.CO2是氧化产物,N2既是氧化产物又是还原产物
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com