
题目列表(包括答案和解析)
5.以下表示氦原子结构的化学用语中,对电子运动状态描述最详尽的是
A.:He B.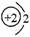 C.1s2 D.
C.1s2 D.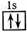
4.下列实验能达到实验目的且符合安全要求的是

3.(09年广东理基·22)下列关于硅单质及其化合物的说法正确的是
①硅是构成一些岩石和矿物的基本元素
②水泥、玻璃、水晶饰物都是硅酸盐制品
③高纯度的硅单质广泛用于制作光导纤维
④陶瓷是人类应用很早的硅酸盐材料
A.①② B.②③ C.①④ D.③④
2.用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA
B. 1 mol Cl2与足量Fe反应,转移的电子数为3nA
C.由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA
D.1L浓度为1mol·L-1的Cu(NO3)2溶液中含有NA个Cu2+
1.广州将于2010年承办第16界亚运会。下列措施有利于节能减排、改善环境质量的有
①在大亚湾核电站已安全运行多年的基础上,广东将继续发展核电,以减少火力发电带来的二氧化硫和二氧化碳排放问题
②积极推行“限塑令”,加快研发利用二氧化碳合成的聚碳酸酯类可降解塑料
③加速建设地铁轻轨等轨道交通,促进珠三角城市一体化发展,减少汽车尾气排放
④发展低碳经济、循环经济,推广可利用太阳能、风能的城市照明系统
⑤使用生物酶降解生活废水中的有机物,使用填埋法处理未经分类的生活垃圾
A.①②③④ B.①②⑤ C.①②④⑤ D.③④⑤
22.(14分)。
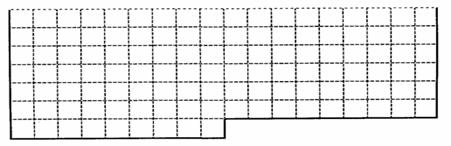
(1)上表中的实线是元素周期表部分边界,请在表中用实线补全主族元素的边界。
(2)元素甲是第三周期ⅦA族元素,化合物A是由甲元素等非金属元素组成的离子化合物。
写出其电子式 ,化合物A是由甲的氢化物与电解质B生成的,写出其反应的离子方程式: 。
有同学认为B中存在氢键,请画出其存在氢键示意图(氢键用“…”)
(3)元素乙的氢化物在周期表中最稳定的,它的单质可以与水反应产生氧气,写出其反应的化学方程式:
(4)金属元素丙形成的化合物通常用于鉴别CO2,则元素丙的离子与元素元素甲的简单离子的半径大小关系 (用离子符号表示),比丙元素多一个质子的元素在周期表的位置是 。
(5)单质甲与NaOH按物质的量之比1:1发生反应,写出其反应的离子方程式:

|
 葫芦岛市世纪高中2010届高三上学期
葫芦岛市世纪高中2010届高三上学期21.Ⅰ(7分)已知:乙酸乙酯(CH3COOCH2CH3)熔 点 -83.6℃ 沸点:77.2℃ 溶解性难溶于水,溶于多数有机溶剂 密度小于水。乙酸:熔点为16.6℃,沸点为117.9℃乙酸易溶于水和乙醇及其他有机溶剂。乙醇:沸点:78.5℃.能与水以任意比互溶。
CH3COOCH2CH3 +
H2O  CH3COOH + CH3CH2OH
CH3COOH + CH3CH2OH
实验目的:验证不同条件下,乙酸乙酯(CH3COOCH2CH3)的水解程度。
实验步骤:甲、乙、丙三位同学分别在等体积的乙酸乙酯中分别加入NaOH溶液、蒸馏水、稀硫酸,在相同条件下(同温度、同用量、同时进行)。
实验现象与结论:甲想通过观察油层的消失时间来判断不同条件下乙酸乙酯的水解程度; 乙想通过测定乙酸的浓度或含量来判断不同条件下乙酸乙酯的水解程度;
丙想通过.............。
根据上述回答下列问题:
(1)甲同学为何可以通过观察油层的消失时间来达到实验目的:
(2)你认为乙同学能否通过比较水解后溶液的pH变化来说明其不同条件下的水解程度的大小? (填“能”或“否”)理由是:
(3)你认为丙同学可以通过 来判断不同条件下乙酸乙酯的水解程度。
Ⅱ.(6分)必修二有一演示实验:将约20gBa(OH)2·8H2O晶体研细后与约10gNH4Cl晶体一起放入烧杯中,并将烧杯放在滴有几滴水的玻璃片或小木板上,用玻璃棒快速搅拌,片刻。
(1)试着用手拿起烧杯,能观察到的现象是 ,说明反应是
(填“吸热”或“放热”)
(2)某同学在炎热的暑假,用同样的方法做此实验,你认为能否观察到上述实验现象?
(填“是”或“否”。若否,则应如何改进实验并说明现象
若能,则此空不填。
20.(10分)写出满足下列条件的氧化还原反应的方程式
(1)有水生成的分解反应化学方程式: ;
(2)有水参加的化合反应的化学方程式: ;
(3)有水参与既不做氧化剂也不做还原剂化学方程式: ;
(4)水只做氧化剂的离子方程式: ;
(5)水既做氧化剂又做还原剂的化学方程式: ;
19.(9分)硫酸是重要的化工原料,其中合成SO3是制硫酸的重要步骤。请根据下列要求回答问题:
(1)下列关于反应2SO2(g)+O2(g) 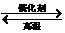 2SO3(g) △H <0的说法正确是 (填字母)
2SO3(g) △H <0的说法正确是 (填字母)
A.升温可以加快合成SO3的速率同时提高SO2的转化率
B.寻找常温下的合适催化剂是未来研究的方向
C.由于△H<0,△S<0,故该反应一定能自发进行
D.当SO2的浓度保持不变时,说明反应达到平衡状态
E.当v(O2)生成=2v(SO3)消耗时,说明反应达到平衡状态
F.在实际生产中,使用400-500℃,从经济效益考虑,更有利于生产
(2)将0.050 mol SO2和0.030 molO2充入容积为2L的密闭容器中,反应在一定条件下达到平衡,测得反应后容器压强缩小到原来压强的75%,则该条件下SO 2的转化率为______;该条件下的平衡常数为__________。
(3)若当(2)中反应在530℃下达到平衡后,恒温下将容器容积从1L缩小到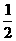 L,则平衡向_____(填“正”或“逆”)反应方向移动。请结合化学平衡常数来说明平衡移动的原因,要求写出推导过程。
L,则平衡向_____(填“正”或“逆”)反应方向移动。请结合化学平衡常数来说明平衡移动的原因,要求写出推导过程。
18.已知NO2和N2O4可以相互转化:
2NO2(g) 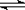 N2O4(g);△H<0。现将一定量NO2和
N2O4(g);△H<0。现将一定量NO2和
 N2O4的混合气体通入体积为1 L的恒温密闭容器中,
N2O4的混合气体通入体积为1 L的恒温密闭容器中,
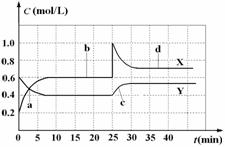
反应物浓度随时间变化关系如图。
下列说法错误的是 ( )
A.图中共有两条曲线X和Y,其中曲线X表示NO2浓度随时间的变化
B.a、b、c、d四个点中,表示化学反应处于平衡状态的点是b和d
C.若要达到与d相同的状态,在25 min时还能采取的措施是适当缩小容器体积
D.反应进行至25 min时,曲线发生变化的原因是加入0.4 mol N2O4
第Ⅱ卷 选择题(共46分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com