
题目列表(包括答案和解析)
12.已知NaHSO4在稀溶液中的电离方程式为:NaHSO4=Na++H++SO2-4。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液pH为2。对于该溶液,下列叙述错误的是 ( )
A.该温度高于25 ℃
B.由水电离出来的c(H+)=1×10-10 mol/L
C.c(H+)=c(OH-)+c(SO2-4)
D.该温度下加入等体积pH为12的NaOH溶液,可使反应后的溶液恰好呈中性
11.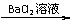
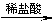 用下面的方案进行某些离子的检验,其中方案设计合理的是
( )
用下面的方案进行某些离子的检验,其中方案设计合理的是
( )
A.检验试液中的SO2-4:试液 无沉淀 白色沉淀
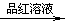
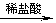
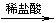
 B.检验试液中的SO2-3:试液 无色气体
溶液褪色
B.检验试液中的SO2-3:试液 无色气体
溶液褪色

 C.检验试液中的CO2-3:试液
白色沉淀 沉淀溶解
C.检验试液中的CO2-3:试液
白色沉淀 沉淀溶解
D.检验试液中的Fe2+:试液 无现象 溶液变红
10.下列说法正确的是 ( )
A.1 mol气体只有在标准状况时,其体积才能为22.4 L
B.在一定温度和压强下,气体体积的大小主要取决于气体分子之间的距离
C.同温同压下,N2和O2的混合气体与等体积的NO气体具有相同的原子数
D.Na2O2与足量的水反应生成1 mol O2,所转移的电子为4 mol
9.已知同周期三种元素X、Y、Z的最高价氧化物所对应的水化物的化学式分别是HXO4、H2YO4、H3ZO4,下列推断正确的是 ( )
A.原子半径:X>Y>Z B.稳定性:HX<H2Y<ZH3
C.非金属性:X<Y<Z D.还原性:X-<Y2-<Z3-
8.已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
①CuSO4溶液和Na2CO3溶液:
主要:Cu2++CO2-3+H2O=Cu(OH)2↓+CO2↑
次要:Cu2++CO2-3=CuCO3↓
②CuSO4溶液和Na2S溶液:
主要:Cu2++S2-=CuS↓
次要:Cu2++S2-+2H2O=Cu(OH)2↓+H2S↑
下列几种物质的溶解度大小的比较中,正确的是 ( )
A.CuCO3>Cu(OH)2>CuS B.CuS>Cu(OH)2>CuCO3
C.Cu(OH)2>CuCO3>CuS D.Cu(OH)2>CuS>CuCO3
7.将标准状况下的2.24 L CO2通入150 mL 1 mol/L的NaOH溶液中,下列说法正确的是 ( )
A.c(HCO-3)略大于c(CO2-3) B.c(HCO-3)略小于c(CO2-3)
C.c(HCO-3)等于c(CO2-3) D.c(Na+)等于c(CO2-3)与c(HCO-3)之和
6.下列说法正确的是 ( )
A.由非金属元素组成的化合物一定是共价化合物
B.阴阳离子相互作用后形成的一定是离子化合物
C.失去电子难的原子,获得电子的能力一定强
D.电子层结构相同的不同离子,核电荷数越多,半径越小
5.对于达到平衡的可逆反应:A(g)+3B(g) 2C(g);△H<0,下列说法正确的是 ( )
2C(g);△H<0,下列说法正确的是 ( )
A.降低温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动
B.在一定温度下,减小压强,平衡向逆反应方向移动,B的浓度增大
C.在恒温、恒容条件下,向平衡体系中加入A物质,C的体积分数增加
D.在恒温、恒压条件下,将平衡体系中各物质的物质的量均减少一半,平衡不移动
4.已知25 ℃、10l kPa时:
4Al(s)+3O2(g)=2Al2O3(s),△H=-2834.9 kJ/mol;
4Al(s)+2O3(g)=2Al2O3(s),△H=-3119.1 kJ/mol。
由此得出的结论正确的是 ( )
A.O3比O2稳定,由O2变O3为吸热反应
B.O2比O3稳定,由O2变O3为放热反应
C.等质量的O2比O3能量低,由O2变O3为吸热反应
D.等质量的O2比O3能量低,由O2变O3为放热反应
3.在下列情况下,溶液中一定能大量共存的离子组是 ( )
A.能使pH试纸变深蓝色的溶液中:SO2-4、SO2-3、CO2-3、Na+
B.pH=l的溶液:Fe2+、SO2-4、NO-3、Cl-
C.由水电离出的c(H+)=l×l0-12 mol/L的溶液中:K+、Na+、AlO-2、ClO-
D.含有大量Al3+的溶液:Na+、NH+4、SO2-4、HCO-3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com