
题目列表(包括答案和解析)
22.氯气溶于水达到平衡后,若其他条件不变,只改变某
一条件,下列叙述正确的是
A.再通入少量氯气 C(H+) /C(ClO-),减小
B.通入少量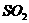 ,溶液漂白性减弱
,溶液漂白性减弱
C.加入少量固体 ,一定有
,一定有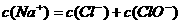
D.加入少量水,水的电离平衡向正反应方向移动
12.下列叙述正确的是:
A.将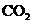 通入
通入 溶液中至饱和,无沉淀产生;再通入
溶液中至饱和,无沉淀产生;再通入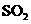 ,产生沉淀
,产生沉淀
B.在稀硫酸中加入铜粉,铜粉不溶解;再加入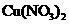 固体,铜粉仍不溶解
固体,铜粉仍不溶解
C.纯锌与稀硫酸反应产生氢气的速率较慢;再加入少量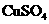 固体,速率加快
固体,速率加快
D.向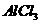 溶液中滴加氨水,产生白色沉淀;再加入足量
溶液中滴加氨水,产生白色沉淀;再加入足量 溶液,沉淀不消失
溶液,沉淀不消失
11.用CH4催化还原NOx可以消除氮氧化物的污染。已知:
①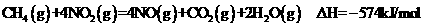
②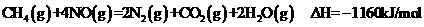
③ 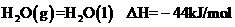
下列说法不正确的是
A.等物质的量的CH4参加反应,反应①②转移的电子数相同
B.0.2 mol CH4还原NO2至N2,且生成H2O(g)放出的热量为173.4kJ
C.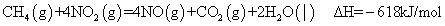
D.若用4.48 L(标准状况)CH4还原NO2至N2,整个过程中转移电子1.60mol
10.由下列实验事实得出的结论正确的是
|
|
实验事实 |
结论 |
|
A |
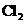 的水溶液可以导电 的水溶液可以导电 |
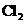 是电解质 是电解质 |
|
B |
在空气中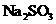 易变质, 易变质,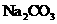 不易变质 不易变质 |
酸性: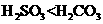 |
|
C |
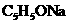 溶液中通 溶液中通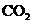 气体出现浑浊 气体出现浑浊 |
酸性: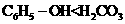 |
|
D |
常温下白磷可自燃而氮气须在放电时才与氧气反应 |
非金属性: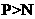 |
9.下列说法都正确的是:
① 江河入海口三角洲的形成通常与胶体的性质有关
② 四川灾区重建使用了大量钢材,钢材是合金
③“钡餐”中使用的硫酸钡是弱电解质
④ 太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置
⑤ 常用的自来水消毒剂有氯气和二氧化氯,两者都含有极性键
⑥ 水陆两用公共汽车中,用于密封的橡胶材料是高分子化合物
A. ①②③④ B. ①②④⑥ C. ①②⑤⑥ D. ③④⑤⑥
8.下列反应的离子方程式书写正确的是
A. 稀硫酸滴在铜片上: Cu+2H+=Cu2++H2↑
B.硫酸钙悬浊液中滴加碳酸钠溶液: 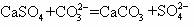
C.用硫化亚铁与稀硝酸反应制H2S气体:FeS + 2H+ = Fe2+ + H2S↑
D.酸性条件下KIO3溶液与KI溶液反应生成I2: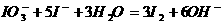
7.化学与科学、技术、社会、环境密切相关。下列说法不正确的是:
A.家用铁锅用水清洗后放置在干燥处,能减弱电化学腐蚀
B.某些抗酸药的主要成分是碳酸钠,作用是中和胃里过多的盐酸
C.加热能杀死甲型H1N1流感病毒是因为病毒的蛋白质受热变性
D.建国60周年燃放的焰火是某些金属元素焰色反应所呈现出来的色彩
23.(15分)已知 :反应①N2(g)+3H2(g) 2NH3(g) ΔH=-92 kJ·mol-1。
2NH3(g) ΔH=-92 kJ·mol-1。
|
②4NH3+5O2===== 4NO+6H2O (ΔH<0)
(1)在500℃、2.02×107Pa和铁催化条件下向一密闭容器中充入1molN2和3molH2,充分反应后,放出的热量______(填“<”“>”“=”)92.4kJ,理由是________ _________;
(2)为有效提高氢气的转化率,实际生产中宜采取的措施有____________;
A.降低温度 B.最适合催化剂活性的适当高温 C.增大压强
D.降低压强 E.循环利用和不断补充氮气 F.及时移出氨
(3) 反应②的化学平衡常数表达式K=________________,当温度升高时,K值______(填“增大”、“减小”或“无影响”);
(4)在0.5L的密闭容器中,加入2.5mol N2 和 7.5mol H2,当该反应达到平衡时,测出平衡混合气的总物质的量为6 mol,则平衡时氮气的转化率为 。
22.(12分)某固体混合物可能由Al 、(NH4)2SO4、MgCl2 、FeCl2 、AlCl3 中的一种或几种组成,现对该混合物作如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):

回答下列问题:
(1)写出反应④的离子方程式___________________________________________.
(2) 混合物中一定存在的物质是 (填化学式)
21.某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)2、H2O、H2O2
已知该反应中H2O2只发生如下过程:H2O2→ O2
(1)该反应中的还原剂是 。
(2)该反应中,发生还原反应的过程是 → 。(填化学式)
(3)写出该反应的化学方程式, 。
(4)如反应转移了0.3mol电子,则产生的气体在标准状况下体积为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com