
题目列表(包括答案和解析)
5.将一块银白色的金属钠放在空气中会发生一系列的变化:表面迅速变暗→“出汗” →变成白色固体(粉末),下列有关叙述不正确的是
A.表面迅速变暗是因为钠与空气中的氧气反应生成了氧化钠
B.“出汗”是因为生成的氢氧化钠吸收空气中的水蒸气在表面形成了溶液
C.最后变成碳酸粉末
D.该过程的所有化学反应均为氧化还原反应
4.下列过程中,需要吸收能量的是
A.H+H=H2 B.H+Cl=HCl C.I2→I+I D.S+O2=SO2
3.下列各组物质的类别归属正确的是
A.同位素: 1H2、2H2、3H2 B.非电解质:Cl2、BaSO4、C2H5OH
C.分子晶体: I2、SO3、固态氩 D.纯净物: 重水、双氧水、矿泉水
2.我国第五套人民币中的一元硬币材料为钢芯镀镍,依据你所掌握的电镀原理,你认为在硬币制作时,钢芯应做
A.阴极 B.阳极 C.正极 D.负极
1.“显微学的新前沿”被列为美国科学杂志2006年度十大科技进展之一。生物学家借助新的显微技术,成功观察到小于200纳米的细节。下列分散系中,分散质微粒半径最小的是
A.雾 B.蛋白质溶液
C.NaCl溶液 D.新制氢氧化铜悬浊液
33.(14分) 碘化钠是常用的分析试剂,还用于医疗、照相业。工业上用铁屑还原法制备NaI,其主要流程如下,请回答问题:
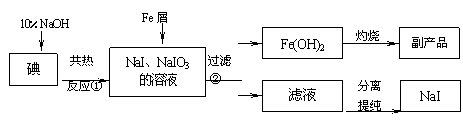
已知:NaI易被空气氧化;反应②为:3Fe + IO3-+ 3H2O = 3Fe (OH)2 ↓ +I-
⑴实验室灼烧Fe(OH)2主要在 进行(填仪器名称);
灼烧后的副产品是 (写化学式)。
⑵判断①中碘单质是否完全反应的实验方法是
;
⑶测定产品中NaI含量的方法是:(I:127)
a.称取3.000 g样品、溶解,在250 mL容量瓶中定容;b.量取25.00 mL待测溶液于锥形瓶中;c.用0.1000 mol·L-1AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为19.00 mL。
①测定过程所需仪器在使用前需要检查是否漏液的有 。
② 该样品中NaI的质量分数为 。
③ 若测定结果偏低,试分析可能的原因(任写两条):
、 。


 徐闻中
徐闻中
学2010届高三第十二次周测
理科综合能力测试答卷(化学部分)2009.12.26
32.(22分)在实验室里可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
图中:① 为氯气发生装置;
② 的试管里盛有15 mL 30% KOH溶液。并置于水浴中;
③ 的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;
④ 的试管里加有紫色石蕊试液; ⑤ 为尾气吸收装置。
请填写下列空白:
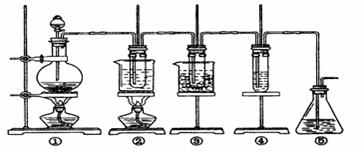
⑴制取氯气时,在烧瓶里加入一定量的二氧化锰。通过 (填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气氢气体,可在①与②之间安装盛有 (填写下列编号字母)的净化装置。
 A.碱石灰 B.饱和食盐水 C.浓硫酸 D.饱和碳酸氢钠溶液
A.碱石灰 B.饱和食盐水 C.浓硫酸 D.饱和碳酸氢钠溶液
⑵比较制取氯酸钾和次氯酸钠的条件,
二者的差异是:
反应完毕经冷却后,②的试管中有大
量晶体析出。右图中符合该晶体溶解
度曲线的是 (填写编号字母);
从②的试管中分离出该晶体的方法是 (填写实验操作名称);
⑶本实验中制取次氯酸钠的离子方程式是: 。
⑷实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
|
实验现象 |
原因 |
|
溶液最初从紫色逐渐变为 色 |
氯气与水反应生成的H+使石蕊变色 |
|
随后溶液逐渐变为无色 |
|
|
然后溶液从无色逐渐变为
色 |
|
31.(12分)四种短周期元素A、B、C、D的性质或结构信息如下。
信息① 原子半径大小:A>B>C>D
信息② 四种元素之间形成的某三种分子的比例模型及部分性质:

甲:是地球上最常见的物质之一,是包括人类在内所有生命生存的重要资源,也是生物体最重要的组成部分。
乙:无色,无味而易燃,是21世纪的主要能源。
丙:有强氧化性,可以用于消毒杀菌。
请根据上述信息回答下列问题:
⑴甲、乙、丙中含有共同元素是 (填元素符号)。
⑵B元素在周期表中的位置 ,写出A原子的电子排布式 。
⑶上述元素的原子M层有一个未成对P电子数的是 (填元素符号)。
⑷B形成的单质晶体可能为 。
A.离子晶体 B.分子晶体 C.原子晶体 D.金属晶体
30.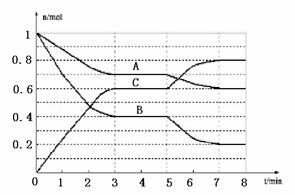 (16分)在一体积为2L的密闭容器中,气态物质A、B、C的物质的量n(mol)随时间t的变化 如右图所示。已知,平衡后,降低温度,A的转化率增大。
(16分)在一体积为2L的密闭容器中,气态物质A、B、C的物质的量n(mol)随时间t的变化 如右图所示。已知,平衡后,降低温度,A的转化率增大。
⑴根据上图数据,从反应开始到达第一次平衡时的平均速率v(A)为 。
⑵写出此反应的平衡常数表达式:K= ;此正反应为 (填“吸热”或“放热”)反应。
⑶已知在5~7min内平衡常数K值增大,则此处曲线
变化的原因是 。
 ⑷下图表示此反应的反应速率v和时间t的关系图
⑷下图表示此反应的反应速率v和时间t的关系图
各阶段的平衡常数如下表所示:
|
t2 ~ t3 |
t4 ~ t5 |
t5 ~ t6 |
|
K1 |
K2 |
K3 |
根据上图判断,K1.K2.K3之间的关系为: (用“>”.“<”或“=”连接)。C的平衡百分含量最高的一段时间是 。
⑸工业上生产硫酸,其中重要的一步反应是:
2SO2(g)+O2
(g)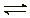 2SO3(g)
2SO3(g)
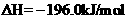
①生产中同时提高反应速率和SO2的转化率,下列措施可行的是 (填字母)。
A.向装置中充入过量的SO2 B.向装置中充入过量的O2
C.使用更高效的催化剂 D.升高温度
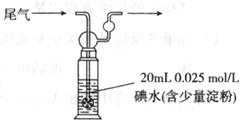
②硫酸工业尾气中二氧化硫含量超过0.055%(体积分数)时需要加以处理后才能排放。现用右图所示装置测定尾气中SO2的含量,当通入尾气11.2 L(标准状况)时,碘水恰好褪色。通过计算用数字说明该尾气能否直接排放
 (已知:
(已知: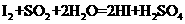 )
)
23.在一定温度下的定容密闭容器中,当下列物理量不再变化时,表明反应
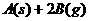

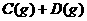 已达平衡的是:
已达平衡的是:
A.混合气体的压强 B.混合气体的平均分子量
C.气体的总物质的量 D.B的物质的量浓度
广东省
徐闻中学2010届高三第十二次周考
理科综合能力测试
第Ⅱ卷(非选择题 共182分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com