
题目列表(包括答案和解析)
20.(8分) A、B、C、D、E都是元素周期表中前20号的元素,原子序数依次增大,B、C、、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水。A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子(用“●”表示)位于该正方体的顶点或面心;阴离子(用“○”表示)位于小正方体的中心。
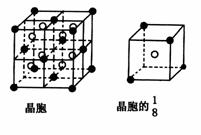 根据以上信息,回答下列问题:
根据以上信息,回答下列问题:
(1)比较A和D的氢化物,后者的沸点较低,其原因是 ;
(2) B的离子结构示意图为 。元素C在元素周期表中的位置是 ;
(3) A和E形成的化合物的电子式是 。
19.(14分)Ⅰ.课本中介绍了乙醇氧化的实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2 mL乙醇的试管里,反复操作几次。注意闻生成物的气味,并观察铜丝表面的变化。
⑴实验室可采用化学方法替代“闻生成物的气味”,写出该化学方法的化学反应方程式 。
⑵某同学在探究“闻生成物的气味”的替代方法时,偶然发现向溴水中加入乙醛溶液,溴水褪色。该同学为解释上述现象,提出两种猜想:① 溴水将乙醛氧化为乙酸; ② 溴水与乙醛发生加成反应。请你设计一个简单的实验,探究哪一种猜想正确?
。
 Ⅱ.某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等装置已略去。实验时,先加热玻璃管中的铜丝,约1min后鼓入空气。请填写下列空白:
Ⅱ.某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等装置已略去。实验时,先加热玻璃管中的铜丝,约1min后鼓入空气。请填写下列空白:
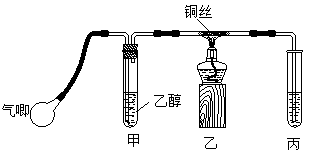
⑴乙醇发生催化氧化的化学反应方程式为____________________________________。
⑵实验时,常常将甲装置浸在70℃-80℃的水浴中,目的是____________________;由于装置设计上的缺陷,实验进行时可能会 。
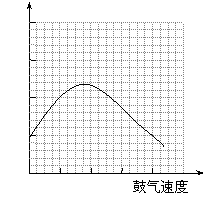
⑶反应发生后,移去酒精灯,利用反应自身放出的热量可维持反应继续进行。进一步研究表明,鼓气速度与反应体系的温度关系曲线如图所示。试解释鼓气速度过快,反应体系温度反而下降的原因: ;你认为该实验中“鼓气速度”这一变量可用 来计量。
18.(8分)为防止碘缺乏病,,通常在食盐中加入KIO3。
⑴用淀粉碘化钾溶液和稀硫酸可定性检验出食盐中的IO3-,表示该反应的离子方程式是____________________________________,若要确认食盐中还含有K+,方法是____ __________________________________________________________________________。
⑵工业上以石墨和铁为电极电解KI溶液制取KIO3。电解时,石墨作_________(填“阳极”或“阴极”),石墨电极上的电极反应式是____________________________,电解过程中铁电极附近溶液pH__________(填“变大”、“变小”或“不变”)。
17.(6分)实验室有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验,请完成下列填空
取20.00 mL待测稀盐酸放入锥形瓶中,并滴加2-3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作2-3次,记录数据如下:
|
实验 编号 |
NaOH溶液的浓 度(mol·L-1) |
滴定完成时滴入NaOH溶液的体积(mL) |
待测盐酸溶液的体积(mL) |
|
1 |
0.10 |
22.62 |
20.00 |
|
2 |
0.10 |
22.72 |
20.00 |
|
3 |
0.10 |
23.80 |
20.00 |
①滴定达到终点的标志是__________________________________________________。
②根据上述数据,可计算出该盐酸的物质的量浓度约为_______(保留两位有效数字)。
 ③排去碱式滴定管中气泡的方法应采用操作______,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
③排去碱式滴定管中气泡的方法应采用操作______,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_________。(多选扣分)A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥
D.称量前NaOH固体中混有Na2CO3固体
E.配制好的NaOH标准溶液保存不当,部分与空气中的CO2反应生成了Na2CO3
F.碱式滴定管尖嘴部分有气泡,滴定后消失
0.5molN2、1.5molH2,反应一段时间后,A、B中均达到平衡状态。下列判断正确的是
A.A中吸热92.4kJ B.B中放热46.2kJ
C.A中热量变化值大于B中的2倍 D. A中热量变化值等于B中的2倍
第Ⅱ卷(非选择题 共86分)
16、密闭容器A、B,A中通入1molN2、3molH2,B中通入
15.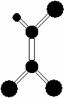 据调查,劣质的家庭装饰材料会释放出近百种能引发疾病的有害物质,其中一种有机物分子的球棍模型如右图,图中“棍”代表单键、双键或三键,不同大小的球代表不同元素的原子,且三种元素位于不同的短周期。下面关于该物质的叙述正确的是
据调查,劣质的家庭装饰材料会释放出近百种能引发疾病的有害物质,其中一种有机物分子的球棍模型如右图,图中“棍”代表单键、双键或三键,不同大小的球代表不同元素的原子,且三种元素位于不同的短周期。下面关于该物质的叙述正确的是
A.有机物化学式为C2HCl3
B.该分子为非极性分子
C.该有机物难溶于水
D.可由乙炔和氯化氢加成得到
14.阿伏加德罗常数约为6.02×1023 mol-1,下列说法正确的是
A.常温下,l mol氯气与熟石灰完全反应转移电子数为2×6.02×1023
B.44g二氧化碳中含有的共用电子对数目为2×6.02×1023
C.标准状况下,22.4L 甲醛所含的分子数约为6.02×1023
D.常温常压下,20g重水(D2O)所含的中子数为8×6.02×1023
13.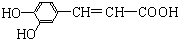 咖啡酸具有止血、镇咳、祛痰等疗效,其结构简式为
。下列有关咖啡酸的说法中,不正确的是
咖啡酸具有止血、镇咳、祛痰等疗效,其结构简式为
。下列有关咖啡酸的说法中,不正确的是
A.咖啡酸分子中的所有原子可能共平面
B.咖啡酸可以发生还原、酯化、加聚、显色等反应
C.1 mol咖啡酸可与4 mol Br2发生反应
D.1 mol咖啡酸与NaOH溶液反应最多消耗1 mol的NaOH
12.下列反应的离子方程式正确的是
A.将铜片投入足量稀硝酸:Cu+NO3-+4H+==Cu2++NO↑+2H2O
B.草酸和少量烧碱溶液:H2C2O4+OH-==HC2O4-+H2O
C.苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2===2C6H5OH+CO32-
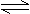 D.实验室制备氢氧化铁胶体:Fe3++3H2O?
Fe(OH)3(胶体)+3H+
D.实验室制备氢氧化铁胶体:Fe3++3H2O?
Fe(OH)3(胶体)+3H+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com