
题目列表(包括答案和解析)
18.(8分)
已知氯气与水的反应 是一个可逆反应,即不能进行到底的反应,且反应生成的次氯酸(
是一个可逆反应,即不能进行到底的反应,且反应生成的次氯酸( )是一种酸性比碳酸还要弱的酸。
)是一种酸性比碳酸还要弱的酸。
(1)分别写出盐酸、次氯酸的电离方程式 、
。
(2)要使新制氯水里次氯酸的浓度增大,可向其中加入下列的 。
A、 固体 B、水
C、
固体 B、水
C、 固体
固体
D、 固体 E、
固体 E、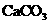 固体
固体
(3)根据次氯酸及有关物质的性质判断,下列反应的离子方程式正确的是
A、氯气溶解于水: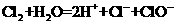
B、氯气溶于石灰水:
C、漂白粉溶液中通入足量CO2: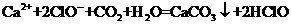
D、漂白粉溶液中通入足量SO2: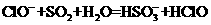
17. (12分)
A、B、C、D为四种常见的短周期元素,常温下,A、B可形成两种常见的液态化合物,其最简式分别为BA和B2A,B与D可以形成分子X,也可从形成阳离子Y,X、Y在水溶液中的酸、碱性正好相反,A、C也可形成两种常见的化合物,其最简式分别为CA和C2A。
(1)C元素是 (填元素符号),位于元素周期表的第 周期第 族。液态X的电离类似B2A的电离,且产生两种电子数相等的离子,则液态X的电离方程式为 。
(2)M、N是这四种元素中任意三种元素组成的不同类型的强电解质,M的水溶液呈碱性,N的水溶液呈酸性,且物质的量浓度相等的M、N溶液中,水的电离程度是前者小于后者。则M、N的的化学式分别为 、 若将0.1mol/L的M溶液与0.2mol/L的N溶液等体积混合,所得溶液的所有离子中浓度第二大的离子是
25.(1)______________
(2)________________________________________________ _____________
24.(1)________________________________________ ________________
(2)____________________________________________________________
(3)____________________________________________________________
(4)_______________
23.(1)_____________________________________________________________
(2)____________________________________________________________
(3)_____________________________________________________________
(4)正极:________________________________________________________
负极:________________________________________________________
22.(1)_____________________________________________________________
(2)____________________________________________________________
(3)_____________________________________________________________
(4)_____________________________________________________________
(5)_____________________________________________________________
21.(1)①________________________________________
②________________________________________
(2)_____________________________________________________________
(3)①___________________________________________________________
②___________________________________________________________
25.(8分)取两份等浓度的NaOH溶液A和B,每份10 mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1 mol·L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,试回答下列问题:
(1)原NaOH溶液的物质的量浓度为
mol·L-1
(2)曲线A表明,原NaOH溶液中通入CO2后,所得溶液中的溶质为(写化学式) ;其物质的量之比为 。
(3)曲线B表明,原NaOH溶液中通入CO2后,所得溶液加盐酸产生CO2气体体积(标准状况)的最大值为 mL。
福建省福州八中2010届高三毕业班第三次质检 化学答题卷
选择题答案写在机答卡上
24.(9分)硫酸铵是一种常用的铵态氮肥。下表是硫酸铵化肥品质的主要指标。
|
指标 项目 |
优等品 |
一等品 |
合格品 |
|
外观 |
白色结晶,无可见机械杂质 |
无可见机械杂质 |
|
|
氮(N)含量 |
≥21.0% |
≥21.0% |
≥20.5 |
某化学研究性学习小组为本地农业生产服务,对某农用品商店出售的一等品硫酸铵化肥的品质进行探究。
[观察外观] 该硫酸铵化肥无可见机械性杂质
[实验探究]
按右图所示装置进行实验。
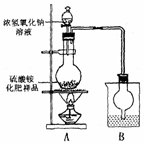 (1)烧瓶内发生反应的离子方程式为:__________烧杯中盛放的试剂最好是____________________(填“浓硫酸”、“稀硫酸”或“水”)
(1)烧瓶内发生反应的离子方程式为:__________烧杯中盛放的试剂最好是____________________(填“浓硫酸”、“稀硫酸”或“水”)
(2)实验过程中,需往烧瓶中加入足量浓氢氧化钠溶液并充分加热的原因是___。
[交流讨论]
(3)甲同学:根据此实验测得的数据,计算硫酸铵化肥的含氮量可能偏高,因为实验装置中存在一个明显缺陷:______________。
乙同学实验装置中还存在另一个明显缺陷是:缺少赶尽反应装置中残留氨气的装置。
经过大家充分讨论一致认为:针对甲、乙两位同学指出的实验装置中存在明显缺陷,需改进实验装置,重新进行实验。
[探究结论]
 (4)称取13.5g硫酸铵化肥样品,用改进后的实验装置重新进行实验,测得实验后B装置增重3.4g。则该化肥______________(填“是”或“不是”)一等品。
(4)称取13.5g硫酸铵化肥样品,用改进后的实验装置重新进行实验,测得实验后B装置增重3.4g。则该化肥______________(填“是”或“不是”)一等品。
23.(15分) 甲醇是可再生燃料,可以利用天然气等物质生产,生产成本低,用途广泛。最近有科学家提出:把含有过量CO2的空气(通常情况下空气中CO2的体积分数为0.030%,当空气中CO2的体积分数超过0.050%时,会引起明显的温室效应。)吹入碳酸钾溶液中,然后再把CO2从溶液中提取出来,经化学反应后得到甲醇,其构想技术流程如下:

试回答下列问题:
(1)写出吸收池中主要反应的离子方程式_____________________________。
(2)写出分解池中反应的化学方程式为_______________________________。
(3)在合成塔中,若有4.4kg CO2与足量H2恰好完全反应,可放出4950 kJ的热量,试写出合成塔中发生反应的热化学方程式________________________________。
(4)甲醇的一个重要作用是可以制燃料电池,3%的甲醇水溶液在一种合金催化剂的作用下,在某一电极被氧化为CO2气体和H+;输送到另一电极室的空气或氧气,获得电子并与H+结合成水。该电池工作的总反应式为:CH3OH+3O2====4H2O+2CO2 请写出两个电极上发生的电极方程式:
正极: 负极:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com