
题目列表(包括答案和解析)
1.下列叙述中,可以说明金属甲的活动性比金属乙的活动性强的是
A.在氧化还原反应中,甲原子失去的电子比乙原子失去的电子多
B.同价态的阳离子,甲比乙的氧化性强
C.甲能跟稀盐酸反应放出氢气而乙不能
D.将甲乙作电极组成原电池时,甲是负极
4、分析电解应用的主要方法思路
①离子移向:阴离子移向 极,阳离子移向 极
②放电能力:
阳极:金属阳极> > > >
>OH->NO >SO
>SO
阴极: >Hg2+>Fe3+> >H+>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+。
③电极反应:(电解饱和食盐水为例)
电极反应式: 、 。
总反应式: 。
④电解结果:
两极现象 ;
水的电离平衡 ;
溶液酸碱性 、PH值变化 。
基础训练
3、金属的腐蚀和防护
①金属腐蚀的本质是
②金属腐蚀的类型及比较
|
|
化学腐蚀 |
电化学腐蚀 |
|
条件 |
金属与非电解质等直接接触 |
不纯金属或合金与电解质溶液接触 |
|
现象 |
无电流产生 |
有微弱电流产生 |
|
本质 |
金属被氧化的过程 |
较活泼金属被氧化的过程 |
|
相互关系 |
化学腐蚀与电化学腐蚀往往同时发生,但电化学腐蚀更普遍危害更严重 |
③金属腐蚀快慢的判断: > > >
a.电解原理引起的腐蚀 b.有防腐蚀措施的腐蚀 c.化学腐蚀 d.原电池原理引起的腐蚀
同一种金属的腐蚀:强电解质>弱电解质>非电解质
④金属的防护方法:(1) (2) (3)
2、原电池的电极、电池反应式的写法。
①铅蓄电池:负极为 ,正极为 电解质溶液为硫酸。
负极:
正极:
电池反应:Pb+PbO2+2H2SO4 2PbSO4+2H2O
2PbSO4+2H2O
②银-锌高能电池:由负极为 ,正极为 ,电解质为KOH溶液。
( )极 Zn-2e+2OH- ZnO+H2O:( )极 Ag2O+2e+H2O
ZnO+H2O:( )极 Ag2O+2e+H2O 2Ag+2OH-
2Ag+2OH-
电池总反应:
③宇宙飞船上使用的氢氧燃料电池。H2为 极,氧气为 极,电解质为KOH溶液。
负极(H2):
正极(O2):
电池反应:2H2+O2 2H2O
2H2O
1、原电池、电解池、电镀池判断规律
若无外电源,可能是 ,然后依据原电池的形成条件判定,主要思路是三“看”
先看电极:两种活泼性不同的金属(或其中一种非金属导体)作电极
再看溶液:用导线连接的两电极与 电解质溶液接触并形成闭合回路。
后看回路:在电解质溶液中能发生的氧化还原反应。
21、(16分)如图,有甲、乙两容器,甲体积可变,压强不变,乙保持体积不变。向两容器中分别充入1 molA、3 molB,此时两容器体积均为500 ml。保持两容器温度相同且不变,发生反应

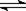
 ;△H<0。
;△H<0。

(1)下列选项中能表明甲和乙容器中反应一定达到平衡状态的是( )
A、混合气体的总质量不随时间改变 B、
C、A、B转化率相等 D、物质D的质量不随时间而变
(2)2min后甲容器中反应达到平衡,测得C的浓度为2 mol·L-1。此时容器的体积为
mL,B的转化率为 (B)为
。用A的物质的量变化表示该反应的平均反应速率为
。
(B)为
。用A的物质的量变化表示该反应的平均反应速率为
。
(3)乙容器中反应达到平衡所需时间
2min(填>、<或=),B的转化率 (B)
(B)  (B)(填>、<或=)。
(B)(填>、<或=)。
(4)其他条件不变,甲中如果从逆反应开始建立平衡,要求平衡时C的物质的量与(2)中平衡时C的物质的量相等,则需起始加入C的物质的量n(C)= mol,加入D的物质的量n(D)应满足的条件为 。
20、
 (16分)右图所示为常见气体制备、分离、干燥和性质验证的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题(仪器装置可任意选用,必要时可重复选择,a、b为活塞)。
(16分)右图所示为常见气体制备、分离、干燥和性质验证的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题(仪器装置可任意选用,必要时可重复选择,a、b为活塞)。
(1)若气体入口通入CO和CO2的混合气体,E内放置CuO。选择装置获得纯净干燥的CO,并验证其还原性及氧化产物,所选装置的连接顺序为 (填代号)。能验证CO氧化产物的现象是 。
(2)停止CO和CO2混合气体的通入,E内放置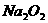 ,按A→E→D→B→H装置顺序制取纯净干燥的O2,并用O2氧化乙醇。此时,活塞a应
,活塞b应 ,需要加热的仪器装置有
(填代号),m中反应的化学方程式为 。
,按A→E→D→B→H装置顺序制取纯净干燥的O2,并用O2氧化乙醇。此时,活塞a应
,活塞b应 ,需要加热的仪器装置有
(填代号),m中反应的化学方程式为 。
(3)若气体入口改通空气,分液漏斗内改加浓氨水,圆底烧瓶内改加NaOH固体,E
内放置铂铑合金网,按A→G→E→D装置顺序制取干燥的氨气,并验证氨的某些性质。
①装置A中能产生氨气的原因有:
。
②实验中观察到E内有红棕色气体出现,证明氨气具有 性。
19、 (10分)右图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去),已知:
(10分)右图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去),已知:

 (a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体。(b)反应①、②是化工生产中的重要反应。(c)化合物E是形成酸雨的污染物之一,化合物K是常用的氮肥。(d)化合物L具有漂白性,可由
(a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体。(b)反应①、②是化工生产中的重要反应。(c)化合物E是形成酸雨的污染物之一,化合物K是常用的氮肥。(d)化合物L具有漂白性,可由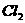 与
与 溶液反应而制得。(e)化合物J由两种元素组成,其相对分子质量为32.(f)化合物H的组成中阳离子和阴离子数目为
1﹕1.
溶液反应而制得。(e)化合物J由两种元素组成,其相对分子质量为32.(f)化合物H的组成中阳离子和阴离子数目为
1﹕1.
 请按要求填空:
请按要求填空:
 (1)反应③的化学方程式
。
(1)反应③的化学方程式
。
 (2)C的结构式
;H的化学式
。
(2)C的结构式
;H的化学式
。
 (3)L的溶液与化合物E反应的离子方程式
。
(3)L的溶液与化合物E反应的离子方程式
。
 (4)化合物J的化学式
。
(4)化合物J的化学式
。
18、 (10分)短周期元素Q、R、T、W在元素周期表中的位置如下图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
(10分)短周期元素Q、R、T、W在元素周期表中的位置如下图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:

 (1)T的原子结构示意图为
。
(1)T的原子结构示意图为
。
 (2)元素的非金属性Q W(填>或<或=)。
(2)元素的非金属性Q W(填>或<或=)。
 (3)W的单质与其最高价氧化物的水化物浓溶液共热生成两种物质,其中一种是气体,反应的化学方程式为
。
(3)W的单质与其最高价氧化物的水化物浓溶液共热生成两种物质,其中一种是气体,反应的化学方程式为
。
 (4)原子序数比R多1的元素有两种氢化物,通过分解反应二者可实现转化的反应方程式为
。
(4)原子序数比R多1的元素有两种氢化物,通过分解反应二者可实现转化的反应方程式为
。
 (5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下2L甲与0.5L
O2相混合,若该混合气被足量NaOH溶液吸收后无气体残留,且生成的R含氧酸盐只有一种,则该盐的化学式是
。Blog/?UserId=997609
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下2L甲与0.5L
O2相混合,若该混合气被足量NaOH溶液吸收后无气体残留,且生成的R含氧酸盐只有一种,则该盐的化学式是
。Blog/?UserId=997609
17、 (8分)某温度时,水的离子积常数Kw=1.0×10-13,将此温度下PH=11的
(8分)某温度时,水的离子积常数Kw=1.0×10-13,将此温度下PH=11的 溶液aL与PH=1的
溶液aL与PH=1的 溶液bL混合。该混合液体积为两者之和,所得固体体积忽略不计。
溶液bL混合。该混合液体积为两者之和,所得固体体积忽略不计。
 (1)若所得混合液为中性,则a﹕b=
,生成沉淀的物质的量为 (用含a、b的表达式表示)。
(1)若所得混合液为中性,则a﹕b=
,生成沉淀的物质的量为 (用含a、b的表达式表示)。
 (2)若a﹕b=9﹕2,则所得溶液PH=
,该混合液最多能够溶解铁粉 g。
(2)若a﹕b=9﹕2,则所得溶液PH=
,该混合液最多能够溶解铁粉 g。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com