
题目列表(包括答案和解析)
2、反应热的概念与表示方法
概念: 表示方法:用Q表示,Q 0表示吸热,Q 0表示放热。
1、化学反应的实质:化学反应的过程即 断裂( 能量)和 形成( 能量)。故每一个化学反应都必然伴随着能量变化。
练习:写出下列微粒的电子式
N: S C F K+: Mg2+: O2-: Cl-: O22-:
NaCl: MgCl2: Na2O:
用电子式表示下列微粒形成过程:
NaCl: HCl:
1、离子键和共价键比较
|
比较类型 |
离子键 |
共价键 |
|
定义 |
|
|
|
成键微粒 |
|
|
|
成键性质 |
|
|
|
成键方式 |
|
|
|
成键条件 |
|
|
|
存在 |
|
|
|
实例 |
|
|
离子化合物: 如:
共价化合物: 如:
3.氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图
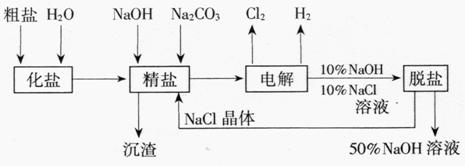
依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生反应的化学方程式为 ,与电源负极相连的电极附近,溶液pH (选填“不变”“升高”或“下降”)。
(2)工业食盐含Ca2+、Mg2+等杂质。精制过程发生反应的离子方程式为
、 。
(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以
是 (选填a,b,c多选扣分)。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为 (选填a、b、c多选扣分)。
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过 、冷却、 (填写操作名称)除去NaCl
(6)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为 。
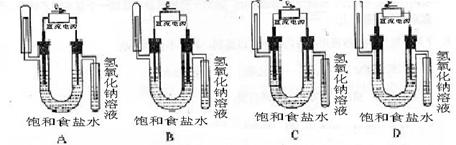
2.下图中能验证氯化钠溶液(含酚酞)电解产物的装置是
1.通以相等的电量,分别电解等浓度的硝酸银和硝酸亚汞(亚汞的化合价为+1)溶液,若被还原的硝酸银和硝酸亚汞的物质的量之比n(硝酸银)∶n(硝酸亚汞)=2∶1,则下列表述正确的是
A 在两个阴极上得到的银和汞的物质的量之比n(硝酸银)∶n(硝酸亚汞)=2∶1
B 在两个阳极上得到的产物的物质的量不相等
C 硝酸亚汞的分子式为HgNO3
D 硝酸亚汞的分子式为Hg2(NO3)2
14.下图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到336mL(标准状态)气体。回答:
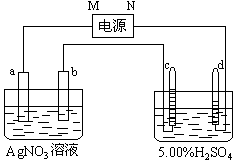
(1)直流电源中,M为 极。
(2)Pt电极上生成的物质是 ,其质量为 g。
(3)电源输出的电子,其物质的量与电极b、c、d分别生成的物质的物质的量之比为:2∶ ∶ ∶ 。
(4)AgNO3溶液的浓度(填增大、减小或不变。下同) ,AgNO3溶液的pH ,H2SO4溶液的浓度 ,H2SO4溶液的pH 。
(5)若H2SO4溶液的质量分数由5.00%变为5.02%,则原有5.00%的H2SO4溶液为 g。
选做题
13.电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
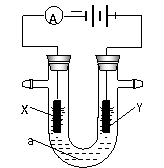 (1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为 。在X极附近观察到的实验现象是 。
②Y电极上的电极反应式为 。检验该电极反应产物的方法是 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是 ,电极反应式为 。
②Y电极的材料是 ,电极反应式为 。
(说明:杂质发生的电极反应不必写出)
12.实验室用铅蓄电池作电源电解饱和食盐水制取氯气,已知铅蓄电池放电时发生如下反应:负极Pb+SO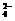 ====PbSO4+2e-,正极PbO2+4H++SO
====PbSO4+2e-,正极PbO2+4H++SO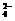 +2e-====PbSO4+2H2O今若制得Cl2
0.050mol,这时电池内消耗的H2SO4的物质的量至少是( )
+2e-====PbSO4+2H2O今若制得Cl2
0.050mol,这时电池内消耗的H2SO4的物质的量至少是( )
A.0.025 mol B.0.050 mol C.0.10 mol D.0.20 mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com