
题目列表(包括答案和解析)
3、 从矿物学资料查得,一定条件下自然界存在如下反应:
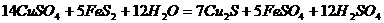 ,下列说法正确的是
,下列说法正确的是
A. Cu2S既是氧化产物又是还原产物 B. 5mol FeS2发生反应,有10mol电子转移
C. 产物中的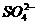 离子有一部分是氧化产物 D. FeS2只作还原剂
离子有一部分是氧化产物 D. FeS2只作还原剂
2、已知常温下在溶液中可发生如下两个离子反应
Ce4++Fe2+ Fe3++Ce3+ Sn2++2Fe3+ 2Fe2++Sn4+
由此可以确定Fe3+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序是
A.Sn2+、Fe3+、Ce3+ B.Sn2+、Ce3+、Fe2+
C.Ce3+、Fe2+ 、Sn2+ D.Fe3+、Sn2+、Ce3+
1、在下图所表示的微粒中,氧化性最强的是
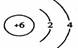
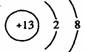

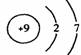
A. B. C. D.
5、所学重要的氧化剂:
所学重要的还原剂:
基础训练
4、氧化性和还原性相对强弱的判断:
(1) 根据元素在周期表中的位置 判断.: 越靠______方,金属单质的______越强,对应阳离子的______越弱。例如 :还原性K___Na___Mg, 氧化性K+___Na+___Mg2+ 。越靠______方,非金属单质的______越强,对应阴离子的______越弱.例如: 氧化性S___Cl2___ F2, 还原性S2-____Cl-____F-。
(2) 根据金属活动性顺序表 判断 : 从左往右 ____________减弱 ____________增强。 例如还原性Zn___Fe___Cu,氧化性Zn2+___Fe2+___Cu2+。
(3) 根据氧化还原反应 判断: 在一个氧化还原反应中,氧化剂的氧化性___氧化产物氧化性;还原剂的还原性___还原产物还原性。例如在反应 Cu+2Fe3+=2Fe2++Cu2+中,氧化性:____大于____;还原性:___大于____。
(4) 根据反应条件 判断 : 反应越容易进行,氧化剂的氧化性____ ,还原剂的还原性______。例如MnO2 KMnO4分别与浓盐酸的反应.条件是_____ 。 所以氧化性MnO2____KMnO4。
(5) 根据元素最高价氧化物的水化物的酸碱性强弱 判断
例如:酸性HClO4___H2SO4___H3PO4___H2CO3,则可判断氧化性C___P___S___Cl。
(6)根据原电池、电解池的电极反应 判断
①两种不同的金属构成原电池的两极,还原性负极___正极
②用惰性电极电解混合溶液时,在阴极先放电的阳离子的_____较强,在阳极先放电的阴离子的_____较强.
3、标出下列反应中元素在反应前后的电子得失情况(双线桥):
1)  MnO2
+ 4HCl(浓 ) == MnCl2 + Cl2
+ 2H2O
MnO2
+ 4HCl(浓 ) == MnCl2 + Cl2
+ 2H2O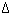
2) Cu + 2H2SO4(浓) === CuSO4 + SO2 + 2 H2O
2、元素化合价 的反应叫氧化反应,在反应中该元素 电子,该元素所在的反应物叫 剂,该元素所在的生成物叫 产物;元素化合价 的反应叫还原反应,在反应中该元素 电子,该元素所在的反应物叫 剂,该元素所在的生成物叫 产物。例如,在以下反应中:
4NH3 + 5O2 = 4NO + 6H2O 是氧化产物, 和 是还原产物。
1、氧化还原反应的实质是 其特征是 .
27、 已知1mol CO气体完全燃烧生成CO2气体,放出283KJ热量,1mol氢气完全燃烧生成液态水放出286KJ热量,1mol CH4气体完全燃烧生成CO2气体和液态水放出890KJ热
 ⑴ 写出H2完全燃烧热化学方程式
⑴ 写出H2完全燃烧热化学方程式
⑵ 若1mol CH4气体完全燃烧生成CO2气体和水蒸汽,放出热量 890KJ(填“ =”、“>””<”)
⑶ 若将a mol CH4,CO,H2混合气体完全燃烧,生成CO2气体和液态水,则放出热量(Q)的取值范围是
⑷若将a mol CH4,CO,H2混合气体完全燃烧,生成CO2气体和液态水,且CO2和H2O物质的量相等,则放出热量(Q)的取值范围是
26、已知P4 (s,白磷)+5O2 (g)=P4O10(s); △H1=-2983.2KJ/mol,
P(s,红磷)+5/4O2(g)=1/4P4O10(s); △H2=-738.5KJ/mol
试写出白磷转化为红磷的热化学方程式:
选做题
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com