
题目列表(包括答案和解析)
4、下列关于元素的叙述正确的是
A.金属元素与非金属元素能形成共价化合物
B.只有在原子中,质子数才与核外电子数相等
C.目前使用的元素周期表中,最长的周期含有36种元素
D.非金属元素形成的共价化合物中,原子的最外层电子数只能是2或8
3、X、Y为短周期元素,X位于IA族,X与Y可形成化合物X2Y,下列说法正确的是
A.X的原子半径一定大于Y的原子半径
B.X与Y的简单离子不可能具有相同的电子层结构
C.两元素形成的化合物中,原子个数比不可能为1 :1
D.X2Y可能是离子化合物,也可能是共价化合物
2、有X、Y两种元素,原子序数≤20,X的原子半径小于Y,且X、Y原子的最外层电子数相同(选项中m、n均为正整数)。下列说法正确的是
A.若X(OH)n为强碱,则Y(OH)n也一定为强碱
B.若HnXOm为强酸,则X的氢化物溶于水一定显酸性
C.若X元素形成的单质是X2,则Y元素形成的单质一定是Y2
D.若Y的最高正价为+m,则X的最高正价一定为+m
1、据报道1994年11月9日德国科学家利用数亿个镍原子(28Ni)对数亿个铅原子(82Pb)连续轰击数天后,制得一种新原子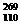 X(暂用X表示),它属于一种新元素-第110号元素,这种新元素是有史以来制得的最重的元素,存在时间不到千分之一秒。经分析它属于过渡元素。下列关于该元素的叙述中正确的是 )
X(暂用X表示),它属于一种新元素-第110号元素,这种新元素是有史以来制得的最重的元素,存在时间不到千分之一秒。经分析它属于过渡元素。下列关于该元素的叙述中正确的是 )
A.这种原子(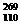 X)的中子数为169 B.这种元素肯定是金属元素
X)的中子数为169 B.这种元素肯定是金属元素
C.这种元素与铅(82Pb)属同一族 D.这种元素属第三周期元素
原子结构
[考点1]原子组成
原子是由 和 构成的, 带正电荷位于原子的中心,其电荷集中在 上; 带负电荷,在原子核外空间做高速运转。
原子的组成可用符号 表示,该符号所能表示的数量关系为
组成原子的几种基本微粒的特点:质子数决定 ; 决定同一元素的不同原子(核素);质子和中子共同决定 ; 和 决定微粒是否带电荷。
[考点2]核外电子排布
在含有多电子的原子里,电子的能量并不相同。通常将原子核外电子的运动空间按能量 的顺序由里向外分成7个电子层,即:
核外电子排布须同时遵循以下四条规律:核外电子总是按照 排布;各电子层最多容纳的电子数为 个;最外层电子数不超过 个,若K层为最外层则不超过 个;次外层电子数不超过 个,倒数第三层不超过 个。
[考点3]元素、核素、同位素及其相互关系
元素是具有相同 的同一类 核素是具有 的一种
同位素是指
某种元素的同位素在自然界中所占的原子数目百分比(丰度)一般不变;各同位素原子的质子数 ,核外电子层结构 ,其原子、单质及其构成的化合物的化学性质
元素周期律和元素周期表
[考点1]元素周期律的内容和实质
元素性质随 的递增而呈现周期性变化的规律叫做元素周期律。 元素性质的周期性变化是由 的周期性变化决定的,此为元素周期律的实质.元素周期律的内容包括:随原子序数的递增元素原子的 呈现 的周期性变化;随原子序数的递增元素 呈现 的周期性变化;随原子序数的递增元素 呈现 的周期性变化.
[考点2]元素周期表的结构
元素周期表是元素周期律的具体表现形式,其结构如下:短周期 ,分别容纳 种元素;长周期 ,分别容纳 种元素;1个不完全周期、现有元素26种。
元素周期表中有 列,分为 个族:7个 、用符号 表示;7个 ,用符号 表示;1个 包含 列;1个 放在最右边。
[考点3]元素在周期表中的位置、原子结构和元素性质之间的关系(位构性关系)
由原子结构可推断元素在周期表中的位置:周期数= ;主族序数=
由元素在周期表中的位置可判断元素的性质:同周期元素从左到右,元素的原子半径逐渐 ;原子失电子能力 而得电子能力 ;元素金属性 而非金属性 ;对应单质的 减弱而 增强;对于主族元素来说其最高正价等于 ,最低负价为 。
元素周期表的应用
[考点1]同周期元素性质的递变
判断元素原子失电子能力强弱的方法:比较元素的单质跟 反应置换出氢气的难易程度,置换反应越容易发生,元素原子的失电子能力 ;比较元素最高价氧化物对应的水化物的 强弱,一般说来, 越强,元素原子的失电子能力越强;比较元素在金属活动性顺序表中的相对位置,金属元素越靠前,其失电子能力 ;依据金属单质间的置换反应,作还原剂的金属元素的失电子能力
于作还原产物的金属元素;比较简单金属阳离子的氧化性强弱,简单金属阳离子的氧化性越强,对应金属元素的失电子能力越 。
判断元素原子得电子能力强弱的方法:比较元素的单质跟 化合的难易程度、条件及生成氢化物的稳定性,越易跟氢气反应,生成的氢化物越稳定,说明氢化物的还原性越弱,则元素原子的得电子能力 ;比较元素最高价氧化物对应的水化物的 强弱,一般说来, 越强,元素原子的得电子能力越强;依据非金属单质间的置换反应,作氧化剂的非金属元素的得电子能力 于作氧化产物的非金属元素;比较简单非金属阴离子的还原性强弱,简单非金属阴离子的还原性越强,对应非金属元素的得电子能力越 。
同周期元素原子的 相同,但从左到右核电荷数依次增多,原子半径逐渐 (稀有气体除外),原子核对外层电子的吸引能力逐渐 ,原子的失电子能力逐渐 ,得电子能力逐渐 ;元素单质的还原性逐渐 ,氧化性逐渐 ;最高价氧化物对应水化物的碱性 ,酸性 ;气态氢化物的稳定性 。
[考点2]同主族元素性质的递变
元素在元素周期表中的 反映了该元素 以及由此决定的元素的 ,因此可以根据某元素在元素周期表中的 ,推测它的 。
同主族元素原子的 相同,但从上到下核电荷数依次增多,所以同主族元素性质既有 又有 :同主族元素从上到下原子半径逐渐 ,原子核对外层电子的吸引能力逐渐 ,原子的失电子能力逐渐 ,得电子能力逐渐 ;元素单质的还原性逐渐 ,氧化性逐渐 ;最高价氧化物对应水化物的碱性 ,酸性 ;气态氢化物的热稳定性 。
[考点3]元素周期表的其它应用
根据同一周期、同一主族元素的相似性和递变规律,利用已知元素和它的化合物的已知性质可推导未知元素及其化合物的性质。
根据在周期表中位置接近的元素性质相似,可利用元素周期表寻找新材料:半导体材料在 寻找;催化剂在 寻找;在 可找到耐高温、耐腐蚀的特种合金材料;含 元素的化合物可用于制作农药;
(Ⅰ基础训练)
18、化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如:

(l)在上述有编号的步骤中,需用还原剂的是 ,需用氧化剂的是 (填编号)。
(2)在上述循环中,既能与强酸反应又能与强碱反应的两性物质是 (填化学式)
(3)完成并配平步骤①的化学方程式,标出电子转移的方向和数目:
□Na2Cr2O7+□KI+□HCl→□CrCl3+□NaCl+□KCl+□I2+□
17、 某化学反应的反应物和产物如下:
KMnO4 + KI+ H2SO4→ MnSO4 + I2 + KIO3 + K2SO4 + H2O
(1)该反应的氧化剂是
B(2)如果该反应方程式中I2和KIO3的系数都是5
①KMnO4的系数是 ②在下面的化学式上标出电子转移的方向和数目
KMnO4 + KI + H2SO4 →
(3)如果没有对该方程式中的某些系数作限定,可能的配平系数有许多组。原因是
。
16、某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)2、H2O、H2O2已知该反应中H2O2只发生如下过程:H2O2→ O2
(1)该反应中的还原剂是 。
(2)该反应中,发生还原反应的过程是 → 。
(3)写出该反应的化学方程式,并标出电子转移的方向和数目
。
(4)如反应转移了0.3mol电子,则产生的气体在标准状况下体积为 。
选做题
15、.24毫升浓度为0.05摩/升的Na2SO3溶液,恰好与20毫升浓度为0.02摩/升的K2Cr2O7溶液完全反应,则元素Cr在被还原的产物中的化合价是
A.+6 B.+3 C.+2 D.0
14.(2007年全国II)在氧化还原反应中,水作为氧化剂的是
A.C+ H2O CO2+ H2
B.3NO2+H2O=2HNO3+NO
CO2+ H2
B.3NO2+H2O=2HNO3+NO
C.2Na2O2+2H2O=4NaOH+O2↑ D.2F2+2H2O=4HF+O2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com