
题目列表(包括答案和解析)
5.某学生设计了如图的方法对A盐进行鉴定:
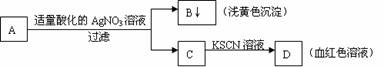
由此分析,下列结论中,正确的是
A.A中一定有Fe3+ B.B为AgI沉淀
C.C中一定有Fe3+ D.A一定为FeBr2溶液
4.制印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应2FeC13+Cu=2FeCl2+CuCl2向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是
A.烧杯中有铜无铁 B.烧杯中有铁无铜
C.烧杯中铁、铜都有 D.烧杯中铁、铜都无
3.钾是活泼的碱金属,钾和氧气反应时可以生成氧化钾(K2O)、过氧化钾(K2O2)和超氧化钾(KO2)等多种化合物,现将钾与氧气在一定条件下的反应产物1.1g溶于水,所得溶液用0.5mol/L的HCl溶液进行滴定,终点时消耗HCl溶液40.00mL,则钾与氧气反应产物的成份可能是
A.K2O B.KO2 C.K2O和K2O2 D.K2O和KO2
2.混合下列各组物质使之充分反应,加热蒸干产物并在300℃灼烧至质量不变,最终残留固体为纯净物的是
A.NaAlO2溶液和过量硫酸 B.等物质的量的NaHCO3和Na2O2固体
C.FeSO4溶液和过量溴水 D.溶质的物质的量相同的(NH4)2SO4溶液和BaCl2溶液
1.下列各组物质相互混合进行反应,既有气体生成最终又有沉淀生成的是
A.金属钠投入CuSO4溶液中 B.过量的NaOH溶液和明矾溶液反应
C.少量烧碱过量的NaHCO3溶液中 D.金属铝投入KOH溶液中
11.聚合硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。用铁的氧化物为原料来制取聚合硫酸铁,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+。实验步骤如下:
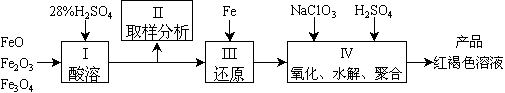 (1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有 。
(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有 。
(a) 容量瓶 (b) 烧杯 (c) 烧瓶
(2)步骤II取样分析溶液中的Fe2+ 、Fe3+ 的含量,目的是 。
(a) 控制溶液中Fe2+与Fe3+ 含量比
(b) 确定下一步还原所需铁的量
(c) 确定氧化Fe2+所需NaClO3的量
(d) 确保铁的氧化物酸溶完全
(3)用NaClO3氧化时反应方程式如下:
6FeSO4+NaClO3+3H2SO4→3Fe2(SO4)3+NaCl+3H2O
若改用HNO3氧化,则反应方程式如下:
6FeSO4+2HNO3+3H2SO4→3Fe2(SO4)3+NO↑+4H2O
已知1mol HNO3价格0.16元、1mol NaClO3价格0.45元,评价用HNO3代替NaClO3作氧化剂的利弊,利是 ,弊是 。
(4)聚合硫酸铁溶液中SO42¯与Fe3+ 物质的量之比不是3︰2。根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中SO42¯与Fe3+物质的量之比。测定时所需的试剂 。
(a) NaOH (b) FeSO4 (c) BaCl2 (d) NaClO3
(5)需要测定 和 的质量(填写化合物的化学式)。
(6)选出测定过程中所需的基本操作(按操作先后顺序列出) 。
(a) 萃取、分液 (b) 过滤、洗涤 (c) 蒸发、结晶
10.1919年,Langmuir提出:原子数相同、电子数相同的分子,互称为等电子体。等电子体的结构相似、物理性质相近,称为等电子原理。后来,该原理被推广使用于一些具有特殊功能的晶体的发现和人工合成等诸多领域。如:X是一种新型无机材料,它与碳化硅(SiC)结构相似、物理性质相近,符合该原理。X有如下的转变:
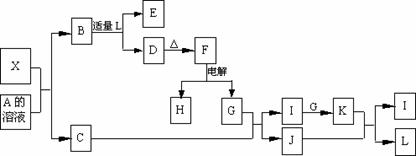
其中:C是气体,D为白色沉淀,E溶液的焰色反应中火焰呈黄色。回答以下问题:
(1)写出X的化学式: 。
(2)①写出X与A溶液反应的化学方程式: 。
②写出K与J反应的离子方程式: 。
③H与L稀溶液反应的离子方程式 。
(3)X与SiC的复合粉末是新一代大规模集成电路的理想散热材料。最近日本科学家研究出一种新物质与气体单质(物质的量1︰2)制备该纳米级复合材料的方法,请将该反应补充完整。
(新物质)+2 (单质)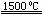 4X+SiC+3C。
4X+SiC+3C。
9.铝的阳极氧化,是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化膜,该氧化膜不溶于稀硫酸。某化学研究小组在实验室中按下列步骤模拟该生产过程。填写下列空白:
(1)配制实验用的溶液。要配制200mL密度为1.2g·cm-3的溶质质量分数为16%的NaOH溶液,需要称取 gNaOH固体。
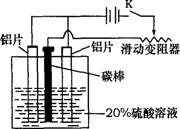 (2)把铝片浸入热的16%NaOH溶液中约半分钟左右洗去油污,除去表面的氧化膜,取出用水冲洗。写出除去氧化膜的离子方程式
。
(2)把铝片浸入热的16%NaOH溶液中约半分钟左右洗去油污,除去表面的氧化膜,取出用水冲洗。写出除去氧化膜的离子方程式
。
(3)如图,组装好仪器,接通开关K,通电约
25min。在阳极生成氧化铝,阴极产生气体。 写
出该过程中的电极反应式:
阳极
阴极
(4)断开电路,取出铝片,用1%稀氨水中和表面的酸液,再用水冲洗干净。写出该过程发生反应的离子方程式
8.下图是向MgCl2、AlCl3混合溶液中,开始滴加7ml试剂A,之后改滴试剂B,所得沉淀ymol 与试剂体积V(ml)间的关系.以下结论不正确的是( )
 A.原混合液中,C(Al3+)∶C(Mg2+)∶C(Cl-)=1∶1∶5
A.原混合液中,C(Al3+)∶C(Mg2+)∶C(Cl-)=1∶1∶5
B.A是NaOH,B是盐酸,且C(NaOH)∶C(HCl)=2∶1
C.从7到9,相应离子反应式H++OH-
 H2O
H2O
D. B是盐酸,A是NaOH,且C(B)=C(A)
7. 将22.6克Mg、Al、Fe溶于过量的1升pH=0的硫酸溶液中,然后向其中加入氢氧化钠溶液使Mg2+、Al3+、Fe2+刚好完全沉淀,用掉氢氧化钠溶液1升,则氢氧化钠溶液的浓度是( )
A.1mol/L B.2mol/L C.3mol/L D.0.5mol/L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com