
题目列表(包括答案和解析)
3.下列推断合理的是( )
A.明矾[KAl(SO4)2·12H2O]在水中能形成Al(OH)3胶体,可用作净水剂
B.金刚石是自然界中硬度最大的物质,不可能与氧气发生反应
C.浓H2SO4有强氧化性,不能与Cu发生剧烈反应
D.将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水色后加热也能恢复原色
2.近期《美国化学会志》报道:中国科学家以二氧化碳为碳源、金属钠为还原剂,在470℃,80 MPa下合成出金刚石,具有深远意义。下列说法不正确的是( )
A.由二氧化碳合成金刚石是化学变化 B.此反应中金刚石是氧化产物
C.金刚石是碳的一种同素异形体 D.此反应中钠元素发生氧化反应
1.石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如下),可由石墨剥离而成,具有极好的应用前景。下列说法正确的是( )
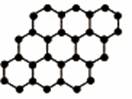 A.石墨烯与石墨互为同位素
A.石墨烯与石墨互为同位素
B.0.12g石墨烯中含有6.02*1022个碳原子
C.石墨烯是一种有机物
D.石墨烯中的碳原子间以共价键结合
12.(36分)某研究小组为了探究“铁与水蒸气”能否发生反应及反应产物,进行了系列实验。
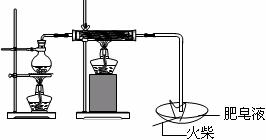 (1)用右图所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒是耐高温材料,不与水反应)。
(1)用右图所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒是耐高温材料,不与水反应)。
反应一段时间后,有肥皂泡吹起时,用点燃的火柴靠近肥皂当
时(填实验现象),说明“铁与水蒸气”能够进行反应。写出铁与水蒸气反应的化学方程式 。
(2)为了研究一定时间内铁粉的转化率,他们设计了如下实验:准确称量一定质量的铁粉进行反应,收集并测量反应后生成的气体体积,计算出铁粉的转化率。
①收集并测量气体体积应选下图中的 装置
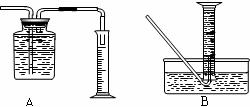
②称取0.24g铁粉与适量石棉绒混合,然后加热至无气体放出。若室温下氢气密度约为0.088g/L,最好选用 规格的量筒(选填字母序号)
A.100ml B.200ml C.500ml D.1000ml
③收集的气体体积为VL,铁粉的转化率为 。
(3)为了证明反应后的固体混合物中含有+3价的Fe,他们计划取出少量混合物于试管中,加入足量的盐酸,溶解,过滤。向滤液中滴加KSCN溶液,观察溶液的颜色。在下表中填写滴加KSCN溶液后可能观察到的现象、结论与解释(可以不填满)。
|
|
现象 |
结论与解释 |
|
可能① |
|
|
|
可能② |
|
|
11.(20分)某混合物的水溶液中,只可能含有以下离子中的若干种:K+、Mg2+、Fe3+、Al3+、Cl−、CO32−、SO42−。现每次取100.00mL进行实验。
①第一份加入AgNO3溶液有沉淀产生;
②第二份加足量BaCl2溶液后,得干燥沉淀6.27g,沉淀经足量盐酸洗涤、干燥后,剩2.33g。试回答下列问题:
(1)c(CO32−)=
(2)K+是否存在? ;若存在,浓度 mol/L(若不存在,则不必回答第二问)。
(3)根据以上实验,有没有哪种离子不能判断是否存在? ,若有,这种离子应如何进行检验?
。
10.(8分)请结合所学知识设计实验,证实AlO2−结合H+的能力比CO32−强,供选试剂:NaOH溶液、AlCl3溶液、CuSO4溶液、pH试纸、NaHCO3溶液、FeCl3溶液(仪器自选)。
①操作要点_________________________________________________________________
_______________ _________________________
__________ _______________;
②能证明AlO2−结合H+的能力强于CO32−的反应的离子方程式:
______________________________________________________________。
9. 将一定质量的镁和铝混合物投入200 mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如右图所示。则下列说法不正确的是
将一定质量的镁和铝混合物投入200 mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如右图所示。则下列说法不正确的是
A.镁和铝的总质量为9 g
B.最初20 mLNaOH溶液用于中和过量的硫酸
C.硫酸的物质的量浓度为2.5 mol·L–1
D.生成的氢气在标准状况下的体积为11.2 L
填选择题答案(每题4分)
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
|
|
|
|
|
|
|
|
|
8.在由Fe、FeO和Fe2O3组成的混合物中加入100mL 2mol/L的盐酸,恰好使混合物完全溶解,并放出448mL气体(S.P.T),此时溶液中无Fe3+。则下列判断正确的是
A.混合物中三种物质反应时消耗盐酸的物质的量之比为1:1:3
B.反应后所得溶液中的Fe2+和Cl–的物质的量之比为1:3
C.混合物中,FeO的物质的量无法确定,但Fe比Fe2O3的物质的量多
D.混合物中,Fe2O3的物质的量无法确定,但Fe比FeO的物质的量多
7.在铁和铜的混合物中,加入一定量的稀硝酸,使之充分反应,剩余金属m1g,再向其中加入一定量的稀硫酸,充分振荡后,剩余金属m2 g,则m1与m2关系是
A.m1一定大于m2 B.m1可能大于m2
C.m1可能等于m2 D.m1一定等于m2
6.从海水中提取镁,可按如下步骤进行:①把贝壳制成石灰乳;②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物;③将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物;④将得到的产物熔融电解得到镁。下列说法不正确的是
A.此法的优点之一是原料来源丰富
B.第④步电解时阴极产生氯气
C.①②③步骤的目的是从海水中提取MgCl2
D.以上提取镁的过程中涉及化合、分解和复分解反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com