
题目列表(包括答案和解析)
1、铁和铁合金是生活中常用的材料,下列说法正确的是( )
A.不锈钢是铁合金,只含金属元素 B.一定条件下,铁粉可与水蒸气反应
C.铁与盐酸反应,铁合金不与盐酸反应 D.在空气中,铁板比镀锌铁板更耐腐蚀
12.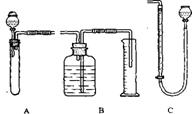 某样品为Na2CO3和NaHCO3固体混合物,现将一定质量的样品与稀盐酸反应,用测定生成CO2体积的方法计算出样品中各组分的质量分数。为较准确地测出生成CO2的体积,在反应结束后加热反应混合物,使溶于溶液中的CO2逸出,待冷却至室温后测CO2的体积(加热时蒸发的水的体积忽略不计)。右图是实验装置图,其中,B和C可供选择。请回答下列问题:
某样品为Na2CO3和NaHCO3固体混合物,现将一定质量的样品与稀盐酸反应,用测定生成CO2体积的方法计算出样品中各组分的质量分数。为较准确地测出生成CO2的体积,在反应结束后加热反应混合物,使溶于溶液中的CO2逸出,待冷却至室温后测CO2的体积(加热时蒸发的水的体积忽略不计)。右图是实验装置图,其中,B和C可供选择。请回答下列问题:
(1)测量CO2气体的体积时,可选用B或C中的一种与A
连接,你将选择____(填B或C),不选另一种的理由是 ____________________________。
(2)在B或C中所盛的液体应为_________(选填编号)。
(A)澄清石灰水 (B)饱和Na2CO3溶液
(C)水 (D)NaOH溶液
(3)在正确选用了B或C中所盛液体后,则实验过程中造成收集到的CO2体积会_________(填“偏大”或“偏小”)。若要使收集到的CO2体积较准确,应对该实验作何改变?____________________________________________。
(4)若测得CO2体积换算成标准状况下是VL(样品为mg),则V的数值范围是_______________(用含m的代数式表示)。
(5)若气体最大量程为50mL,则固体样品的取样范围是______________(假设为标准状况下)。
(6)用此方法测定Na2CO3或NaHCO3质量分数其结果不够准确。现有人设计了下面几种实验方案,请你从中选择一种既简单可行又测定结果较准确的实验方案是___________(选填编号)。
(A)称取一定量样品,配成溶液,加入澄清石灰水,将产生的沉淀过滤、洗涤、干燥、称量,则可计算出样品中各组分的质量分数
(B)称取一定量样品,加热样品使之反应完全,恢复至室温,再称量剩余固体质量,则可计算出样品中各组分的质量分数
(C)称取一定量样品,加热样品使之反应完全,将收集到的CO2称其质量,则可计算出样品中各组分的质量分数
(D)称取一定量样品,加热样品使之反应完全,将用排水法收集到的CO2测出其体积,则可计算出样品中各组分的质量分数
11.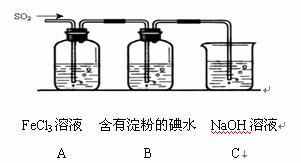 某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:
(1)下列实验方案适用于在实验室制取所需SO2的是 ;
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:
(1)下列实验方案适用于在实验室制取所需SO2的是 ;
A.Na2SO3溶液与HNO3
B.Na2SO3固体与浓硫酸 C.固体硫在纯氧中燃烧
D.碳与热浓H2SO4
(2)写出SO2气体通入A中的离子反应___________________________________________;
(3)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,
取A中的溶液,分成两份,并设计了如下实验: 方案①:往第一份试液中加入KMnO4溶液,紫红色褪去 方案②:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红
上述方案不合理的是 ,原因是 ;
(4)能表明I-的还原性弱于SO2的现象是 。
10. A、B、C均为钠的常见化合物,在空气中露置均易变质,且A的变质过程中伴有明显的颜色变化。已知C是一种消毒剂的有效成分,D、F为常见单质气体,E为主要的大气污染物之一,H溶液显强酸性,N溶液中的阴离子与H溶液中的相同。它们可以发生如图所示的反应。完成下列各题:
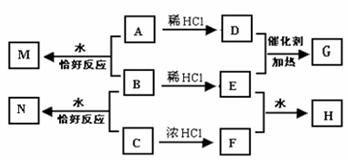
(1)检验A在空气中完全变质的实验操作和现象为 _____________________
(2)B在空气中变质的化学方程式为 _________________________。
(3)B与C在水中反应的离子方程式为 _________________________,若有1molC参加反应,电子转移为 NA(NA为阿伏加德罗常数)。
(4)鉴定H中两种阴离子的实验方案______________________________________。
9.二氧化碳的过量排放,严重影响人类的自下而上环境,处理和利用二氧化碳是全球关注的重大问题。回答:
(1)大气中二氧化碳增加的原因有__________________、__________________________等。
(2)大气中二氧化碳增加,影响植物的生长,例如水果越来越大。这提示我们:随着大气中二氧化碳含量升高,( )
A.植物中的有机物含量降低 B.植物的生长速率降低
C.植物光合作用减弱 D.植物光合作用增强
(3)钟乳石和石笋的主要成分是碳酸钙。随着旅游人数的增加,潮湿溶洞中的钟乳石和石笋受到二氧化碳侵蚀,其化学方程式为:______________________________________。
(4)某学生提出一个修复溶洞底部受损石笋的研究方案,由以下五步组成,正确的实验步骤依次是______________。
①将盛有碱溶液的容器置于石笋的上部; ②配制一定浓度的碱溶液; ③选择合适的碱;④调节碱溶液下滴的速度; ⑤观察石笋表面复原情况
8.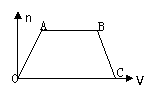 将足量CO2通入NaOH和Ba(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2体积(V)的关系如图,图中AB段表示的先后离子方程式是( )
将足量CO2通入NaOH和Ba(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2体积(V)的关系如图,图中AB段表示的先后离子方程式是( )
①CO2+OH-=HCO3- ②CO2+2OH- =CO32-+ H2O
③CO32-+Ba2+=BaCO3↓ ④ BaCO3+CO2+H2O=Ba2++2HCO3-
⑤CO32-+CO2+H2O=2HCO3-
A.②⑤ B.⑤④ C.④② D.④①
7.氯酸是一种强酸,浓度超过40%时会发生分解:
a HClO3 = bO2↑+ c Cl2↑+ d HClO4 + e H2O,用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色。下列说法正确的是 ( )
A.由反应可确定:氧化性HClO4>HClO
B.若化学计量数a=8,b=3,则该反应转移电子数为32e-
C.变蓝的淀粉碘化钾试纸褪色是因为发生了:5C12 + I2 + 6H2O = 12H+ + 10Cl- + 2IO3-
D.若氯酸分解所得混合气体lmol,其气体质量为47.6g,则反应方程式可表示为:
26HClO3 = 15O2↑+ 8C12↑+ 10HClO4 + 8H2O
6.通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列实验事实的解释正确的是( )
|
|
现象 |
解释 |
|
A |
KI淀粉溶液中通入Cl2,溶液变蓝 |
Cl2能与淀粉发生显色反应 |
|
B |
浓HNO3在光照条件下变黄 |
浓HNO3不稳定,生成有色产物能溶于浓硝酸 |
|
C |
某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 |
说明该溶液中含有SO42- |
|
D |
铜片放入浓硫酸中,无明显变化 |
说明铜在冷的浓硫酸中发生钝化 |
5.在淀粉碘化钾溶液中加入少量次氯酸钠溶液.再加入少量稀硫酸,溶液立即变蓝,在上述溶液中加入足量的亚硫酸钠溶液,蓝色逐渐消失。下列判断不正确的是( )
A.氧化性:C1O- > I2 > SO42-
B.漂白粉溶液可使淀粉碘化钾试纸变蓝
C.向氯水中加入亚硫酸钠溶液,氯水褪色
D.次氯酸钠可以与亚硫酸钠在溶液中共存
4.下列说法错误的是( )
A.Na2SO3溶液与BaCl2溶液混合有白色沉淀生成,加稀HNO3沉淀不消失
B.将SO2气体通入足 量Ba(OH)2溶液中有白色沉淀生成,加足 量HCl后沉淀消失
C.将SO2气体通入BaCl2溶液中有白色沉淀生成,加稀HCl后沉淀消失
D.将SO2气体通入氯水中无沉淀生成, 加入BaCl2溶液有白色沉淀生成
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com