
题目列表(包括答案和解析)
28.(11分)M、R都是生活中常见的金属单质,其中R是用量最多的金属。甲、乙是化合物,其中甲是黑色晶体,可由R在X中燃烧得到。
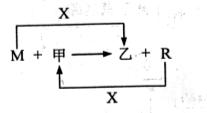
(1) M与甲在高温下反应的化学方程式是 。
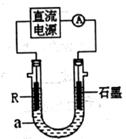
(2) 电解法制R低价氢氧化物的装置如图。a是4mol·L-1NaCl、1mol·L-1NaOH的混合溶液。
① 配制a时需要除去蒸馏水中溶解的O2,常采用 的方法。
② 石墨电极应与电源的 (填“正”或“负”)极相连接,通电后,R电极附近的现象是 ,R极的电极反应式是 .
③ 停止实验一段时间后,在R极上部有红褐色物质产生,反应的化学方程式是 。
(3) 把R的某氧化物粉末与M粉末混合后分成两等份。一份在高温下恰好完全反应后,再与足量盐酸反应;另一份直接放入足量的烧碱溶液中充分反应。前后两种情况下生成的气体质量比是a:b,则R的氧化物的化学式是 。
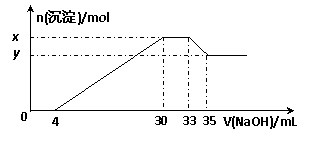
27.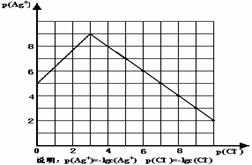 (9分)沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合物的形成等都会使沉淀物的溶解度有所改变。已知AgCl + Cl- = [AgCl2]-, 右图是某温度下AgCl在NaCl溶液中的溶解情况。由以上信息可知:
(9分)沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合物的形成等都会使沉淀物的溶解度有所改变。已知AgCl + Cl- = [AgCl2]-, 右图是某温度下AgCl在NaCl溶液中的溶解情况。由以上信息可知:
(1)由图知该温度下AgCl的溶度积常数为 。
(2)AgCl在NaCl溶液中的溶解出现如图所示情况(先变小后变大)的原因是:
(3)已知S(AgCl)>S(AgI)>S(Ag2S),某溶液中含有Cl-、I-、S2-的浓度都为0.01mol·L-1,现往其中逐滴加入AgNO3溶液,产生沉淀的先后顺序为 。(写化学式)
(4)若在AgCl形成的浊液中滴加氨水有什么现象? 。
发生反应的离子方程式为 。
26.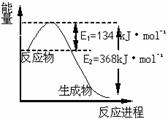 (8分)氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(8分)氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)右图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和 CO反应的热化学方程式
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行
|
t/℃ |
200 |
300 |
400 |
|
K |
K1 |
K2 |
0.5 |
如下化学反应:N2(g)+3H2(g) 2NH3(g)
⊿H<0,
2NH3(g)
⊿H<0,
其化学平衡常数K与温度t的关系如右表:
请完成下列问题;
①试比较K1、K2的大小,K1 K2(填写“>”、“=”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据是 (填序号字母)
a.容器内N2、H2、NH3的浓度之比为1∶3∶2 b.υ(N2)(正)=3υ(H2)(逆)
c.容器内压强保持不变 d.混合气体的密度保持不变
③400℃时,反应2NH3(g) 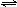 N2(g)+3H2(g)的化学平衡常数的值为
。
N2(g)+3H2(g)的化学平衡常数的值为
。
当测得NH3和N2、H2的物质的量分别为3 mol和2 mol、1 mol时,则该反应的
υ(N2)(正) υ(N2)(逆) (填写“>”、“=”或“<”=)
25.在200 mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol•L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示。
 下列叙述正确的是( )
下列叙述正确的是( )
A.x与y的差值为0.1 mol
B.原溶液中c(Cl-)=0.75 mol·L-1
C.原溶液的pH=1
D.原溶液中n(Mg2+)∶n(Al3+)=5∶2
第II卷 (非选择题 共50分)
24.锑在自然界一般以硫化物的形式存在,我国锑的蕴藏量占世界第一。从硫化物中提取单质锑一般是先在高温下将硫化物转化为氧化物,再用碳还原:①2Sb2S3+3O2+6Fe=Sb4O6+6FeS ②Sb4O6+6C=4Sb+6CO 关于反应①、②的说法正确的是( )
A.反应①②中的氧化剂分别是Sb2S3、Sb4O6
B.反应①中每生成3 mol FeS时,共转移6 mol电子
C.反应②说明高温下Sb的还原性比C强
D.每生成4molSb时,反应①与反应②中还原剂的物质的量之比为4︰3
23.以惰性电极电解一定浓度的CuSO4溶液,一段时间后取出电极,加入9.8 g Cu(OH)2后溶液与电解前相同,则电解时电路中流过的电子为( )
A.0.1mol B.0.2mol C.0.3mol D.0.4mol
22.已知某溶液中只存在OH-、H+、Cl-、NH4+四种离子,其离子浓度可能有如下关系:
① c(Cl-)>c(NH4+)>c(H+)>c(OH-)
② c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③ c(NH4+)>c(Cl-)>c(OH-)>c(H+)
④ c(NH4+) =c(Cl-)>c(OH-)=c(H+)
下列说法正确的是( )
A.若①正确,则溶液中溶质一定为NH4Cl
B.若③正确,则溶液中c(NH3·H2O) + c(NH4+)>c(Cl-)
C.若④正确,且盐酸和氨水体积相等,则盐酸中c(H+)等于氨水中c(OH-)
D.溶质不同时,上述四种关系式均可能成立
21.某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)
+ xB(g)  2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如下图所示。下列说法中正确的是( )
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如下图所示。下列说法中正确的是( )
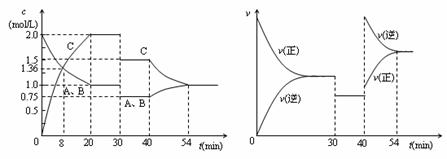
A.30min时降低温度,40min时升高温度
B.反应方程式中的x=1,正反应为吸热反应
C.8min前A的平均反应速率为0.08mol/(L·min)
D.30min-40min间该反应使用了催化剂
20.下列反应的离子于方程式正确的是( )
A.氯化铝溶液与过量的氨水反应:Al3++4NH3·H2O= AlO2-+4NH4++2H2O
B.过量氯气通入碘化亚铁溶液中: Cl2+Fe2++2I-=2Cl-十Fe3+ +I2
C.氢氧化镁加入醋酸: Mg(OH)2+2H+=Mg2++2H2O
D.向碳酸氢钙溶液中加入过量的氢氧化钠:
Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
19.下列各组离子一定能大量共存的是( )
A.含有大量HCO3-的澄清透明溶液中:K+、C6H5O-、Cl-、Na+
B.能与金属铝反应放出氢气的溶液中: K+、NO3-、Cl-、Fe2+
C.常温下水电离出的c(H+)·c(OH-)=10-20的溶液中:Na+、ClO-、S2-、NH4+
D.pH=7的溶液:Fe3+、Mg2+、SO42-、Cl-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com