
题目列表(包括答案和解析)
1.旨在限制发达国家温室气体排放量、抑制全球范围内气候持续变暖的《京都议定书》随着俄罗斯的加入,于2005年2月16日正式生效。我国二氧化碳的排放量位居世界第二,为减少二氧化碳这种温室气体的排放,下列措施不切实际的是
A.大力开发氢能源 B.充分利用太阳能
C.不使用含碳能源 D.提高能源利用率
19. 每小空1分,方程式2分,共8分。
U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在W2中燃烧的产物可使品红溶液褪色。Z和W元素形成的化合物Z3W4具有磁性。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
(1)V的单质分子的结构式为 ;XW的电子式为 ;Z元素在周期中的位置是 。
(2)U元素形成的同素异形体的晶体类型可能是(填序号)
①原子晶体 ②离子晶体 ③分子晶体 ④金属晶体
(3)U、V、W形成的10电子氢化物中,U、V的氢化物沸点较低的是(写化学式) ;V、W的氢化物分子结合H+能力较强的是(写化学式)
(4)YW2气体通入 和
和 的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子
的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子 方程式为
。
方程式为
。
18. (10分)
右图中,A、C是工业上用途广的两种重要化工原料,B为日常生活中常见的金属,H、G是正四面体结构的非极性分子,H是一种重要的能源,J是一种耐高温材料,K是由两种常见元素组成的化合物(图中部分反应物或生成物没有列出)
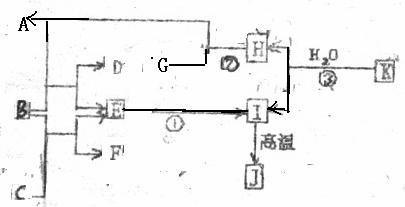
请按要求回答:
(1)写出的电子式 。
(2)反应①的离子方程式为 。
(3)反应②进行的条件是 。
(4)反应③的化学方程式为 。
(5)写出B的高价氧化物对应水化物在水溶液中电离的化学方程式
。
17. (1)(6分)下列实验操作或实验所得出的结论一定正确的是 (填序号)
A、配制100mL1.00mL·L-1的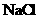 溶液时,可用托盘天平准确称取5.85克
溶液时,可用托盘天平准确称取5.85克 固体
固体
B、某无色溶液中加入盐酸产生无色无味且能使澄清石灰水变浑浊的气体,则该溶液中一定含有大量
C、制备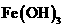 胶体时,应往沸水中加饱和
胶体时,应往沸水中加饱和 溶液,并继续加热到溶液呈红褐色为止
溶液,并继续加热到溶液呈红褐色为止
D、除去蛋白质溶液中混有少量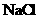 ,加入
,加入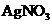 溶液后过滤
溶液后过滤
E、在中学“硫酸铜晶体里结晶水含量的测定”的实验中,至少需要进行四次称量操作
F、测定中和热实验中,每次实验均应测量三个温度,及盐酸起始温度、 溶液起始温度和反应后溶液的最高温度
溶液起始温度和反应后溶液的最高温度
G、酸碱中和滴定实验中,锥形瓶洗净后要用待测液润洗
(2)(6分)
有A、B、C、D、E、F六种溶液,它们是
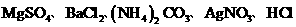 和
和 ,为了鉴别各取少许溶液进行两两混合实验,结果如下表,表中“
,为了鉴别各取少许溶液进行两两混合实验,结果如下表,表中“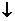 ”表示有沉淀生成或生成微溶物,“
”表示有沉淀生成或生成微溶物,“ ”表示有气体生成,“-”表示观察不到明显的现象变化,由此可判断。
”表示有气体生成,“-”表示观察不到明显的现象变化,由此可判断。
A是 ,
C是 ,
E是 ,
16. 下列说法中正确的是
A、体积相同、pH值相同的①盐酸②硫酸③醋酸,被 溶液完全中和,消耗上述溶液的体积由小到大的顺序是②<①<③
溶液完全中和,消耗上述溶液的体积由小到大的顺序是②<①<③
B、25℃时,0.1mol·L-1氨水和0.05 mol·L-1氯水中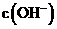 之比是2:1
之比是2:1
C、25℃时,向 溶液中加入适量CH3COOH使混合液pH=7,此时溶液中
溶液中加入适量CH3COOH使混合液pH=7,此时溶液中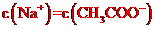
D、向含有 离子的溶液中加入足量的
离子的溶液中加入足量的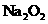 固体后,假设溶液体积不变,则以上四种离子浓度基本保持不变的是
固体后,假设溶液体积不变,则以上四种离子浓度基本保持不变的是 和
和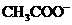
第II卷(非选择题 共55分)
15. 用标准浓度的盐酸滴定未知浓度的氢氧化钠溶液(未知浓度的氢氧化钠溶液置于锥形瓶中),导致滴定实验结果偏高的可能原因是
A、酸式滴定管读数时,滴定前仰视,滴定终了时俯视
B、用滴定管取未知浓度的氢氧化钠溶液时,滴定管用水洗后在用未知浓度的氢氧化钠溶液润洗2-3次
C、盛标准浓度的盐酸的滴定管滴定前尖嘴部位有气泡,滴定后气泡消失
D、滴定时过程中锥形瓶中加入少量蒸馏水
14. 将足量的CO2不断通入KON、 的混合溶液中,生成沉淀与通入CO2的量的关系可表示为
的混合溶液中,生成沉淀与通入CO2的量的关系可表示为
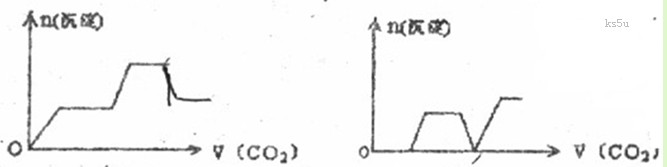
A B
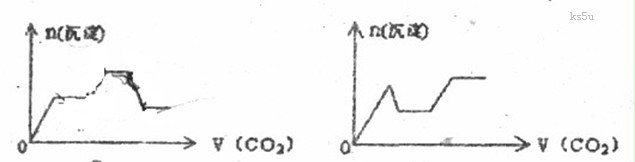
C D
13. 温度相同,浓度均为0.2mol·L-1的①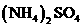 、②
、② 、③
、③ 、④
、④ 、⑤
、⑤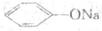 、⑥
、⑥ 溶液,它们的pH由小到大的排列顺序是
溶液,它们的pH由小到大的排列顺序是
A、③①④②⑥⑤ B、①③⑥④②⑤
C、③②①⑥④⑤ D、⑤⑥②④①③
12. 某酸性溶液中只有 四种离子。则下列描述正确的是
四种离子。则下列描述正确的是
A、该溶液由 的CH3COOH与pH=11的
的CH3COOH与pH=11的 溶液等体积混合而成
溶液等体积混合而成
B、该溶液由等物质的量浓度、等体积的 溶液和
溶液和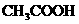 溶液混合而成
溶液混合而成
C、加入适量 ,溶液中离子浓度为
,溶液中离子浓度为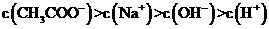
D、加入适量氨水,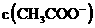 一定大于
一定大于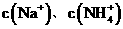 之和
之和
11. 关于下列各装置的叙述中,不正确的是
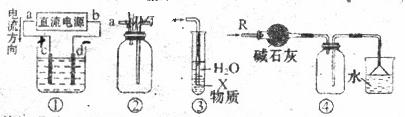
A、装置①中,d为阳极,c为阴极
B、装置②可用于收集H2、NH2、CO2、Cl2、HCl、NO2等气体
C、装置③中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸
D、装置④可用于干燥、收集NH3,并吸收多余的NH3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com