
题目列表(包括答案和解析)
7.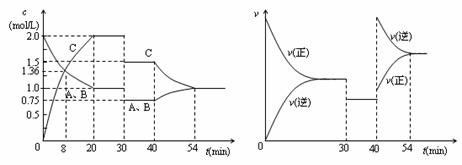 某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)
 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确是( )
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确是( )
A.30min时降低温度,40min时升高温度
B.8min前A的平均反应速率为0.08mol/(L·s)
C.反应方程式中的x=1,正反应为吸热反应
D.20min-40min间该反应的平衡常数均为4
6.某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子。则下列描述正确的是( )
A.该溶液可由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成
B.该溶液由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成
C.加入适量的NaOH,溶液中离子浓度为c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.加入适量氨水,c(CH3COO-)一定大于c(Na+)、c(NH4+)之和
5. 在化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的特殊情况。下列反应中属于这种情况的是 ( )
①过量的锌与18mol/L硫酸溶液反应 ②过量的氢气与少量的N2在催化剂存在下
③浓盐酸与过量的MnO2 ④过量的铜与浓硫酸
⑤过量的稀盐酸与块状石灰石 ⑥过量银与稀硝酸
A.②③④ B.②③⑤ C.①④⑤ D.①②③④⑤
4.已知下列反应的热化学方程式为:
⑴C(s)+O2(g)=CO2(g) ΔH 1=-393.5kJ/mol
⑵CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH 2=-870.3kJ/mol
⑶H2(g)+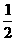 O2(g)=H2O(l) ΔH
3=-285.8kJ/mol
O2(g)=H2O(l) ΔH
3=-285.8kJ/mol
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l) 的反应热(焓变)为 ( )
A.+488.3 kJ/mol B.-488.3 kJ/mol
C.-244.15 kJ/mol D.+244.15 kJ/mol
3. 对下列反应①KHCO3溶液与石灰水反应、②Na2SO3溶液与稀盐酸反应、③Si与烧碱溶液反应、④Fe与稀硝酸反应,改变反应物用量,不能用同一个离子方程式表示的是
A. ①②③ B. ①②④
C. ①③④ D. ②③④
2.下列各组离子一定能大量共存的是( )
A.在含有大量AlO2-的溶液中:NH4+、Na+、Cl-、H+
B.在强碱溶液中:Na+、K+、CO32-、NO3-
C.在pH=12的溶液中:NH4+、Na+、SO42-、Cl-
D.在c(H+)=0.1mol·L-1的溶液中:K+、I-、Cl-、NO3-
1.广口瓶被称为气体实验的“万能瓶”,是因为它可以配合玻璃管和其它简单仪器组成各种功能的装置。下列各图中能用作防倒吸安全瓶的是 ( )

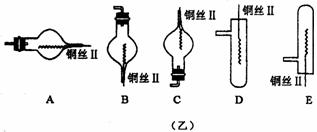
25.(12分)图(甲)是实验室用氢气还原氧化铜实验的微型快速实验装置.其中的粗铜丝“Ⅰ”可以在试管M中上下移动,实验前先将铜丝“Ⅰ”处理成下端弯曲的一小圆环,并用铁锤击成带小孔的小匙,虚线框中需连入图(乙)(仪器上下端位置固定)的某装置进行实验.图乙中的细铜丝“Ⅱ”一端被弯成螺旋状.
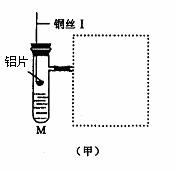
(1)在图甲中,试管M中的液体应选用_____________________________ __.
(2)在图示的虚线框中应连入的最合适的装置是________(填代号)
(3)上述制氢气的方法与将铝片直接加入试管中相比,其优点有_________ _______
______________________________________________________________________.
(4)实验过程中,在试管M中可观察到的现象是________________ _____________
_______________________________________________________________________
___________________________________________________________.
(5)实验时,细铜丝“Ⅱ”的操作方法是________________ ____________________
______________________________________________________________________
__________________________________________.
(6)若实验室无粗铜丝,而改用无锈粗铁丝,为让其反复使用,则此时M中的液体为
________;发生反应的离子方程式为__________________________________.
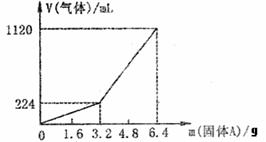 26.(8分)将一定量的混合均匀的铁粉和硫粉在隔绝空气的条件下共热,充分反应后冷却至室温,得到固体A。将质量为m的固体A加入到300mL 2mol·L-1盐酸中使之完全溶解,测得室温下加入的固体A的质量与收集到的气体体积(已换算成标准状况)的关系如图,(假设氢硫酸溶液饱和之前无硫化氢逸出)。
26.(8分)将一定量的混合均匀的铁粉和硫粉在隔绝空气的条件下共热,充分反应后冷却至室温,得到固体A。将质量为m的固体A加入到300mL 2mol·L-1盐酸中使之完全溶解,测得室温下加入的固体A的质量与收集到的气体体积(已换算成标准状况)的关系如图,(假设氢硫酸溶液饱和之前无硫化氢逸出)。
已知加入固体A的质量m≤3.2g时,收集到的气体为氢
气,当m>3.2g时收集到的气体为氢气和硫化氢的混合气。
试分析与计算:
(1)3.2g固体A中所含的物质有
(写化学式) 。
(2)3.2g固体A中各物质的物质的量分别为 。
溶于上述盐酸充分反应后,所得的溶液中氢硫酸的物质的量浓度为(忽略体积变化) 。
(3)当固体A全部溶于上述盐酸,且A的质量m>3.2g时,收集到的气体体积(标准状况下)V= mL。(用含m的代数式)
24.(8分)(2005年广东卷)下图中,A、C是工业上用途很广的两种重要化工原料,B为日常生活中常见的金属,H、G是正四面体结构的非极性分子,H是一种重要的能源,J是一种耐高温材料,K是由两种常见元素组成的化合物(图中部分反应物或生成物没有列出)。
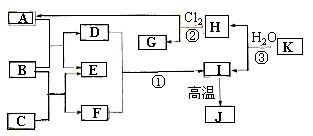
请按要求回答:
(1)写出B的化学式_______________,
G的电子式_________________。
(2)反应①的离子方程式为_______________________________________。
(3)反应③的化学方程式为________________________________________。
23.(6分)已知某溶液中只含有4种离子:A+、B-、H+、OH-,对这4种离子浓度的大小比较,有以下3种说法。请判断离子浓度的大小顺序是否正确,你认为正确的请在相应的空格内填上符合这种情况的A+和B-组成物质的化学式(只写一种情况,可以是一种溶质或两种溶质);你认为一定不正确的,请在相应的空格内填上你选择“不正确”的理由。供选择的离子有:Na+、Ag+、NH4+、Cl-、NO3-、CH3COO-、H+、OH-
(1)c(B-)>c(A+)>c(H+)>c(OH-):
(2)c(A+)>c(B-)>c(OH-)>c(H+):
(3)c(H+)>c(B-)>c(A+) >c(OH-):
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com