
题目列表(包括答案和解析)
21.(11分)设反应①Fe(s)+CO2(g)  FeO(s)+CO(g) 平衡常数为K1
FeO(s)+CO(g) 平衡常数为K1
反应②Fe(s)+H2O(g)  FeO(s)+H2(g) 平衡常数为K2
FeO(s)+H2(g) 平衡常数为K2
测得在不同温度下,K1、K2值如下:
|
温度/℃ |
K1 |
K2 |
|
500 |
1.00 |
3.15 |
|
700 |
1.47 |
2.26 |
|
900 |
2.40 |
1.60 |
(1)若500℃时进行反应①,CO2起始浓度为2mol.L-1,CO2转化率为____ ▲ _____
(2)反应②在常温下为 ▲ 反应 (填“自发或非自发”)。请简述理由
▲
(3)700℃反应②达到平衡,使得该平衡向右移动,其它条件不变时,可以采取的措施有
_ ▲ (填序号)
A、缩小反应器体积 B、加入水蒸气 C、升高温度到900℃ D、使用合适的催化剂
(4)若反应①在体积固定的密闭容器中进行,在一定条件下达到平衡状态,改变下列条件再达平衡后,相应物质的物理量如何变化?(选填“增大”、“减小”或“不变”)
①降低温度,CO2的平衡浓度 ▲ ;
②再通入CO2,CO2的转化率 ▲ 。
(5)下列图像符合反应①的是 ▲ (填序号)(图中v是速率、φ为混合气体CO含量,T为温度)
20.某温度下,在一容积可变的容器中,反应2A(g)+B(g) 2C(g)达平衡时,A、B、C的物质的量分别为4mol、2mol和4mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是
2C(g)达平衡时,A、B、C的物质的量分别为4mol、2mol和4mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是
A.均减半 B.均加倍 C.均增加1mol D.均减小1mol
二:简答题:
19.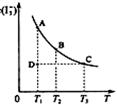 I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq) I3-(aq) , 某 I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。
I3-(aq) , 某 I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。
下列说法正确的是:
A.反应I2(aq)+I-(aq) I3-(aq)的△H>0
I3-(aq)的△H>0
B.若温度为T1、T2,反应的平衡常数分别为K1、K2,则K2>K1
C.若反应进行到状态D时,一定有v正>v逆
D.状态A与状态B相比,状态A的c(I2)大
18.以水为溶剂进行中和滴定的原理是:H3O++OH-=2H2O。已知液态SO2和纯水的导电性相近,因为液态SO2也会发生自离解:SO2(l)+ SO2(l)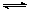 SO32-+SO2+。若以液态SO2为溶剂,用SOCl2滴定Cs2SO3,则以下叙述错误的是
SO32-+SO2+。若以液态SO2为溶剂,用SOCl2滴定Cs2SO3,则以下叙述错误的是
A.该滴定反应可以表示为:SO32- + SO2+ = 2SO2
B.在一定温度下,液态SO2中c(SO32-)与c(SO2+)的乘积是一个常数
C.自离解的存在,说明SO2是离子化合物
D.可通过导电能力变化来判断是否到达滴定终点
17.可逆反应N2(g)+3H2(g)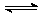 2NH3(g);△H<0,下列研究目的和示意图相符合的是
2NH3(g);△H<0,下列研究目的和示意图相符合的是
|
|
A |
B |
C |
D |
|
研究目的 |
压强对反应的影响(P2>P1) |
温度对反应的影响 |
平衡体系增加N2对反应的影响 |
催化剂对反应的影响 |
|
图示 |
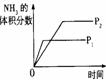 |
 |
 |
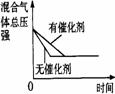 |
16.已知乙硼烷气体(B2H6)在氧气中能剧烈燃烧生成固体三氧化二硼固体和液态水,且生成1mol气态水可放出678kJ的热量,已知:H2O(l)=H2O(g) △H=44 kJ ·molˉ1。 下列能正确表示乙硼烷燃烧热的热化学方程式为
A.B2H6(g)+3O2(g)=B2O3(s)+3H2O(l) △H=-2166kJ ·molˉ1
B.B2H6(g)+3O2(g)=B2O3(s)+3H2O(g) △H=-2034 kJ ·molˉ1

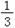 C.B2H6(g)+3O2(g)=B2O3(s)+3H2O(l)
△H=-2078 kJ ·molˉ1
C.B2H6(g)+3O2(g)=B2O3(s)+3H2O(l)
△H=-2078 kJ ·molˉ1
D. B2H6(g)+O2(g)= B2O3(s)+H2O(l) △H=-722 kJ ·molˉ1
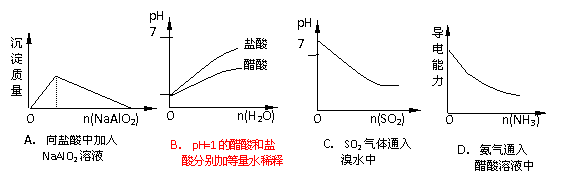
15.下列实验过程中产生的现象与对应图形相符合的是
14.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O  3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
下列叙述不正确的是 A.放电时锌做负极 B.充电时氢氧化铁被氧化 C.放电时溶液的碱性增强 D.放电时转移3mol e-,有2mol FeO42-被还原
13.某同学用下列装置制备并检验Cl2的性质。
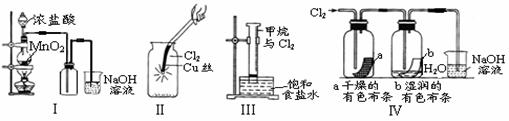
下列说法正确的是
A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗完
B.Ⅱ图中:生成蓝色的烟
C.Ⅲ图中:量筒中发生了加成反应
D.Ⅳ 图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成
12.如图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞和NaCl的琼脂热溶液,冷却后形成琼胶(离子在琼胶内可以移动)。下列叙述正确的是
A.a中铁钉附近呈现红色 B.b中铁钉上发生还原反应
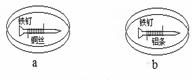 C.a中铜丝上发生氧化反应
C.a中铜丝上发生氧化反应
D.b中铝条附近有气泡产生
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com