
题目列表(包括答案和解析)
26.(10分)铁钉镀锌
(1)该实验为无氰镀锌法,以烧杯作为电解槽,锌片作阳极,镀件铁钉作阴极。
阳极反应式 ,阴极反应式 。
(2)实验仪器:托盘天平,烧杯,玻璃棒,药匙,导线,细纱纸,直流电源,
酒精灯,pH试纸
(3)实验试剂:铁钉,锌片,2mol/LNaOH溶液,固体KCl,固体ZnCl2,浓HCl,浓硝酸,蒸馏水
(4)电解液的配制:先向烧杯中加入50ml蒸馏水,再加入3.5g ZnCl2,12.5gKCl,搅拌使之溶解你认为KCl的作用可能为 ,用硼酸或盐酸调节溶液的pH为5-6。pH太高会 ,pH太低会 。
镀前处理大致包括以下基本内容:除油、除锈、除氧化层、浸蚀、酸洗、活化等。
(5)镀件的处理:用细砂纸打磨铁钉,使铁钉粗糙的表面变得光滑,用水洗净;把铁钉放入到80℃ 2mol/L NaOH溶液中浸泡5分钟,除去油污,用水洗净;再将铁钉放入45℃的浓盐酸中浸泡2分钟,取出,洗净;最后将铁钉放入V(浓硝酸):V(水)=1:100的稀硝酸中浸泡3-5秒,取出,洗净。你认为把镀件放入稀硝酸的作用是 。
(6)电镀操作:用烧杯做电解槽,锌片作阳极,镀件铁钉作阴极,接通6V的支流电源,电解25分钟。
25.(13分) 已知a、b、I、K 四种粒子都有10 个电子,其结构特征如下:
|
粒子 |
a |
b |
I |
K |
|
原子核数 |
单核 |
双核 |
三核 |
四核 |
|
粒子的电荷数 |
一个单位正电荷 |
一个单位负电荷 |
0 |
0 |
A 可作为工业上生产酸J 的原料,B、C 为非金属单质,E 为红棕色固体,物质D 由a、b 构成,G 是一种消毒剂的主要成分。各物质之间的转化关系如下图所示(个别产物略去).
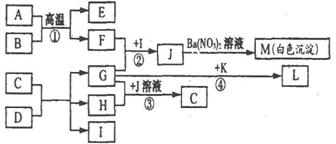
请回答下列问题:
( l )考虑到综合经济效益,工业生产K 时,可采取的措施有____________(填序号)。
a.使用催化剂 b.适当降低温度 c.适当增大压强 d.及时分离出产物 e.对原料进行循环利用 f.充分利用反应本身放出的热量 g.工厂地址选择在交通发达的大城市
( 2 )写出反应② 的离子方程式:_______________________________。
( 3 )反应④ 中,G (溶液)与K 能以物质的量之比为1 : 2 反应生成L、H、I .;L 是一种火箭燃料,其分子中各原子均已达稳定结构.则L 的电子式为______________。
( 4 )将F 通入含等物质的量的D 的溶液中,反应后的溶液能使甲基橙显红色,用方程式来解释 ___________________________________.
( 5 )工业上反应① 应在_________________(填设备名称)中进行.现有1 mol A 参加反应,假设各步均反应完全,生成M 的质量为1165 g ,生成E 的质量为320 g ,则反应① 的化学反应方程式为_____________________________________________。
23.(8分)书写方程式
(1)NH4Ac的电离方程式
(2)NaAlO2的水解离子方程式
(3)NaNO2与NaI在酸性坏境中反应的离子方程式
(4)观察如下反应,总结规律,然后完成下列问题:
Al(OH)3 +H2O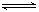 Al(OH)4- + H+
Al(OH)4- + H+
已知B(OH)3是一元弱酸,试写出其电离方程式_______________________________
24(8分).537℃,1.01×105Pa时,在一容积不变的密闭容器中发生如下反应,2SO2(g)+O2(g)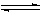 2SO3(g),
2SO3(g),
(1)若开始时,充入容器的起始物质分别是①2molSO2和1molO2②2molSO3和1molN2③4molSO2和2molO2,达到平衡后,容器中SO3的体积分数的大小关系是 ,平均分子量的大小关系是 (用序号和“﹤”“﹥”“﹦”表示)。
(2)537℃,1.01×105Pa时,在一容积可变的密闭容器中发生如下反应,2SO2(g)+O2(g)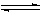 2SO3(g),一开始充入2molSO2和1molO2,此时容器的体积为80L.保持恒温恒压,达到平衡时容器内的密度为起始状态的1.2倍,则SO2的转化率为 。
2SO3(g),一开始充入2molSO2和1molO2,此时容器的体积为80L.保持恒温恒压,达到平衡时容器内的密度为起始状态的1.2倍,则SO2的转化率为 。
(3)温度仍保持537℃,,此时容器的体积为80L(恒容),一开始充入amolSO2和bmolO2.(a=2b)反应达到平衡时容器内的密度与(2)的平衡状态的密度一样,则a= 。
22.某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):
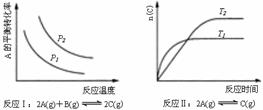
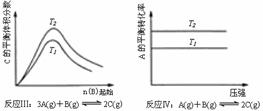
根据以上规律判断,上列结论正确的是( )
A 反应Ⅰ:△H>0,P2>P1 B 反应Ⅱ:△H<0,T1﹤T2
C反应Ⅳ:△H<0,T2>T1 D反应Ⅲ:△H>0,T2>T1;或△H<0,T2<T1
Ⅱ卷
21.用4种溶液进行实验,下表中“操作及现象”与“溶液”对应关系错误的是( )
|
选项 |
操作及现象 |
溶液 |
|
A |
通入CO2,溶液变浑浊。再升高至65℃以上,溶液变澄清。 |
C6H5ONa溶液 |
|
B |
通入CO2,溶液变浑浊。继续通CO2至过量,浑浊消失。 |
NaAlO2溶液 |
|
C |
通入CO2,溶液变浑浊。再加入品红溶液,红色褪去。 |
Ca(ClO)2溶液 |
|
D |
通入CO2,溶液变浑浊。继续通CO2至过量,浑浊消失。
再加入足量NaOH溶液,又变浑浊。 |
Ca(OH)2溶液 |
20.短周期元素E的氯化物ECln的熔点为-78℃,沸点为59℃;若0.2molECln与足量的AgNO3溶液完全反应后可以得到57.4g的AgCl沉淀。下列判断错误的是( )
A.E是一种非金属元素 B.在ECln中E与Cl之间形成共价键
C.E的一种氧化物为EO2 D.E位于元素周期表的IVA族
19. 碳酸钙在工业上有广泛的应用,下列有关说法不正确的是( )
A.炼铁时,碳酸钙的主要作用是造渣
B.海水中提取镁时,碳酸钙的作用是制备氢氧化钙,将海水中的镁离子沉淀出来
C.玻璃工业上碳酸钙作为一种原料,与石英生成硅酸盐
D.硝酸工业用碳酸钙吸收尾气,防止有毒气体排入空气而污染大气
18.铜和镁的合金4.6g完全溶于浓硝酸,若反应中硝酸被还原只生成4480mlNO2和336mlN2O4气体(气体的体积已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为( )
A.9.02 B.8.51 C.8.26 D.7.04
17.下列反应达到平衡后,加水平衡逆向移动的是:( )
A.C(s)+H2O(g) CO(g)+H2(g)
CO(g)+H2(g)
B.Fe3+(aq)+3SCN-(aq) 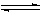 Fe(SCN)3(aq)
Fe(SCN)3(aq)
C.Al3++3H2O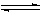 Al(OH)3+3H+
Al(OH)3+3H+
D.HAc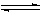 H++Ac-
H++Ac-
16.实验室用启普发生器制氢气,为了提高反应速度,下列措施可行的是:
( )
A.用锌粉替代锌粒 B.给启普发生器加热
C.用浓H2SO4替代稀 H2SO4 D.加入几滴CuSO4溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com