
题目列表(包括答案和解析)
2.下列说法或做法中正确的是
A.氟氯烃的大量排放是造成酸雨的主要原因
B.等质量的同种煤粉和煤块完全燃烧,放出热量前者大于后者
C.液氯泄漏事故发生时,周边的人应该朝顺风方向逃逸或向避风的沟塘低洼处转移
D.火箭发动机有偏二甲肼(C2H8N2)与N2O4混合后充分燃烧,可生成CO2、N2和H2O
1.法新社2006年4月4日报道,天文学家在太空中发现一个长4630亿千米的甲醇气团,
这一天文发现为揭示“原始气体如何形成巨大恒星”提供了有力依据。下列有关甲醇的说法正确的是
A.甲醇能使蛋白质变性 B.甲醇能发生消去反应
C.甲醇不能被催化氧化 D.甲醇与钠反应比水与钠反应剧烈
25.(6分)将一块金属钠投入到100mLMgCl2和AlCl3的混合溶液中,发现沉淀先多后少。反应完毕后收集到13.44L气体(标准状况下),同时得到21.4g白色沉淀,将此沉淀溶于过量的NaOH溶液中,充分反应后沉淀质量减轻了15.6g。求原溶液中Mg2+、Al3+的物质的量浓度。
24.(10分)石油化工是是江苏省的支柱产业之一。丙烯是重要的化工原料,一定条件下可发生下列转化:
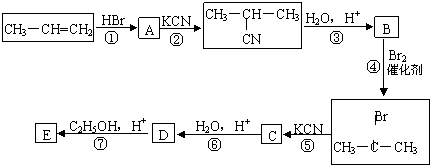
回答下列问题:
⑴A的结构简式为____________________。
⑵反应①-⑦中,属于取代反应的是___________________(填序号)。
⑶D与足量乙醇反应生成E的化学方程式为:
___________________________________________________________________。
⑷B的同分异构体有多种,其中既能发生银镜反应,又能发生酯化反应的同分异构体的结构简式为:
________________________________________________________________________。
23.(8分)2004年10月6日,诺贝尔奖评委会宣布,将2004年度的诺贝尔化学奖颁发给两位以色列科学家和一位美国科学家,以表彰他们揭开了一个关于“死神之吻”的秘密---泛素介导的蛋白质降解。蛋白质部分降解的产物是多肽,完全降解的产物是氨基酸。下面是一个四肽,它可以看作是4 个氨基酸缩合掉3 个水分子而得。
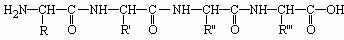
式中,R、R′、R″、 可能是相同的或不同的烃基,或有取代基的烃基。
可能是相同的或不同的烃基,或有取代基的烃基。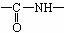 称为肽键。现有一个“多肽”,其分子式是C55H70O19N10,已知将它彻底水解后只得到下列四种氨基酸:
称为肽键。现有一个“多肽”,其分子式是C55H70O19N10,已知将它彻底水解后只得到下列四种氨基酸:
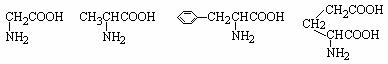
甘氨酸 丙氨酸 苯丙氨酸 谷氨酸
(C2H5NO2 ) (C3H7NO2 ) (C9H11NO2 ) (C5H9NO4 )
⑴该多肽是 (填汉字)肽。
⑵该多肽水解后有 (填数字)个谷氨酸
⑶该多肽水解后有 (填数字)个苯丙氨酸。
22、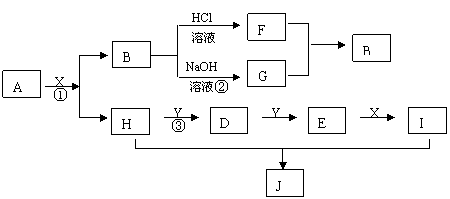 (14分)现有物质A~I,其转化关系如下图所示,已知:A为两种元素组成的化合物,B不溶于水,X常温下为无色液体,E常温下为红棕色气体。(反应中生成的其它物质已略去)
(14分)现有物质A~I,其转化关系如下图所示,已知:A为两种元素组成的化合物,B不溶于水,X常温下为无色液体,E常温下为红棕色气体。(反应中生成的其它物质已略去)
根据上述转化关系图回答:
1)写出下列物质的化学式: X J
2)物质H的电子式: 物质J是属于哪种晶体类型:
3)按要求写出下列方程式
写出反应①的化学方程式 ;
写出反应③的化学方程式 ;
写出反应②的离子方程式 。
21.(8分)有A、B、C、D、E、F六种元素,已知:①它们位于三个不同短周期,核电荷数依次增大;②A与E、B与F分别同主族;③B、C都分别能与D按原子个数比1∶1或1∶2形成化合物。
⑴画出F的原子结构示意图____________________,BD2的电子式是____________。
⑵C、D、E的简单离子半径由大到小的顺序是_____________________(填离子符号)。
⑶F能与B、C、D形成化合物(分别用b、c、d表示),它们的晶体都是原子晶体,晶体中F原子之间不直接通过化学键相连,成键后每个原子最外层均为8个电子。当晶体中含有1 mol F原子时,晶体中所含共价键数目的大小关系是
(填化学式)。
20.(12分)硼酸晶体呈片状,有滑腻感,可作润滑剂,硼酸对人体的受伤组织有缓和和防腐作用,故可以用于医药和食品防腐等方面。试回答下列问题:
(1)从题目信息可知硼酸应属于 酸(弱、强、中强)
(2)硼酸的分子式为H3BO3,已知H与O成键,则其分子结构式为: 。
(3)研究表明:在大多数情况下,元素的原子在形成分子或离子时,其最外层具有达到8电子稳定结构的趋向。已知0.01mol硼酸可以被20mL 0.5mol·L -1NaOH溶液恰好完全中和,据此推测硼酸在水溶液中酸性的原因是(用离子方程式表示)
写出硼酸与NaOH溶液反应的化学方程式:
(4)硼酸和甲醇在浓硫酸存在的条件下,可生成挥发性硼酸酯,试写出硼酸完全酯化的方程式:
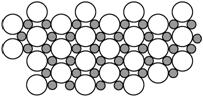 (5)科学家发现硼化镁在39 K时呈超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列,右图是该晶体微观空间中取出的部分原子沿Z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上。根据右图确定硼化镁的化学式为
(5)科学家发现硼化镁在39 K时呈超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列,右图是该晶体微观空间中取出的部分原子沿Z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上。根据右图确定硼化镁的化学式为
(6)某硼烷气体(B2H6)在空气中能剧烈燃烧,生成1mol液态水和B2O3(s)可放出722kJ的热量,请写热化学方程式:
19.(8分)某同学查资料得知α-AgI是一种固体导体,导电率很高。他为了研究α-AgI究竟是Ag+离子导电还是I-离子导电,设计一个如下图所示(用铅蓄电池做电源)的电化学实验。
已知铅蓄电池总反应: 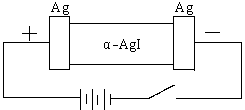 Pb+PbO2+2H2SO4
Pb+PbO2+2H2SO4  2PbSO4+2H2O
2PbSO4+2H2O
(1)该电解池的阳极电极方程式:
铅蓄电池的正极电极方程式:
(2)若Ag+导电,α-AgI本身质量将 。(填不变、变大、或变小)
若I-导电,阳极附近的α-AgI晶体密度将会 。(填不变、变大、或变小)
(3)若通电一段时间后铅蓄电池中消耗了1molH2SO4,则电解池的阴极增重 g。
18.(10分)请按要求填空
⑴ 下列实验操作或对实验事实的描述不正确的是 (填序号)
① 将乙烯、乙炔分别通入溴水中,乙炔使溴水的褪色速度快
② 配置硫酸铜溶液时应向溶液中加入少量的铜粉
③ 实验室可以用双氧水和二氧化锰制取少量的氧气
④ 向氨水中滴加Al2(SO4)3溶液和向Al2(SO4)3溶液中滴加氨水现象相同
⑤ 向某溶液中先通入Cl2再滴加KSCN溶液时溶液变红,证明该溶液一定含有Fe2+
⑥ 将Fe(NO3)2溶液加热蒸发至干并灼烧,最后得到红棕色粉末
⑦ 分别向体积和pH均相同的盐酸和醋酸中滴加等浓度的氢氧化钠溶液,完全中和时消耗的氢氧化钠溶液的体积一样多
⑧在试管中放入几片碎滤纸,滴几滴90%的浓硫酸,再将滤纸捣成糊状,微热并冷却后先滴入几滴CuSO4溶液再加入过量的NaOH溶液加热至沸腾,可观察到红色沉淀生成
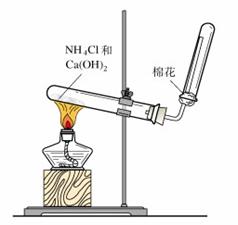 ⑵ 右图是实验室制取和收集氨气的装置图。
⑵ 右图是实验室制取和收集氨气的装置图。
回答下列问题:
① 右图装置中棉花的作用是 ;
② 适当改变图I所示的装置后,也可用来制取和
收集氧气。改变的方法是 ;
③ 实验室用浓硫酸和铜制取并收集少量的SO2气
体,能否采用该装置 (选填“能”或“不
能”),若选填“能”,请说明你的理由;若选填
“不能”,则怎样改变该装置后就能达到实验目
的?请你用文字说明 ;
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com