
题目列表(包括答案和解析)
7. 某溶液中有
某溶液中有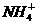 、Mg2+、Fe2+和Al3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是
、Mg2+、Fe2+和Al3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是
 A.
A.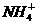 与Fe2+
B.Mg2+与Al3+ C.Fe2+与Al3+ D.Al3+与
与Fe2+
B.Mg2+与Al3+ C.Fe2+与Al3+ D.Al3+与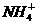
6.从经济效益和环境保护考虑,大量制取硝酸铜最宜采用的方法是
A.Cu+HNO3(浓)→Cu(NO3)2
B.Cu+HNO3(稀)→Cu(NO3)2
 C.Cu
C.Cu CuO
CuO Cu(NO3)2
Cu(NO3)2
 D.Cu+AgNO3→Cu(NO3)2
D.Cu+AgNO3→Cu(NO3)2
5.在室温下等体积的酸和碱的溶液,混合后pH一定小于7的是
A.pH=3的硝酸和pH=11的氢氧化钾溶液
B.pH=3的盐酸和pH=11的氨水
C.pH=3的硫酸和pH=11的氢氧化钠溶液
D.pH=3的醋酸和pH=11的氢氧化钡溶液
4.下列反应中说明NH3既有还原性,又有碱性的是
A.4NH3+5H2O=4NO+6H2O B.NH3+HNO3=NH4NO3
C.8NH3+3Cl2=N2+6NH4Cl D.2NH3+3CuO=3Cu+N2+3H2O
3.不能用来说明金属X比金属Y还原性强的是
A.把X和Y组成的合金放于潮湿的空气中,X先被腐蚀
B.X原子最外层电子数比Y原子最外层电子数少
C.X能从Y的盐溶液中把Y置换出来
D.电解X和Y的盐的混合液,阴极上先析出Y
2.有关晶体的下列说法中正确的是
A.分子晶体中分子间作用力越大,分子越稳定
B.原子晶体中共价键越强,熔点越高
C.冰熔化时水分子中共价键发生断裂
D.氯化钠熔化时离子键未被破坏
1.关于金属元素在自然界存在的情况的叙述中,正确的是
A.金属元素仅存在于矿物中
B.金属元素存在于矿物和动物体内,但植物体内不含
C.大多数金属元素以游离态存在,少数金属元素以化合态存在
D.金属元素不仅存在矿物中,动物和植物体内也存在少量金属元素
21.(14分)已知:①有机物X的相对分子质量小于180,其中氧的质量分数约为49.4%,②1molX在稀硫酸中发生水解反应生成2mol甲醇和1molA,③X中没有支链。④有机物X、A物质能发生如下图转化关系,E为高分子的化合物,B为环状结构。
根据以上信息填写下列空白:
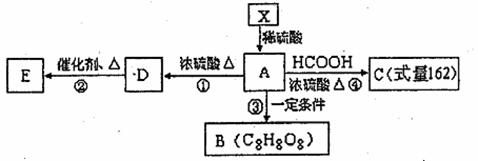
(1)1个X分子中,含有 个氧原子,X不可能发生的反应有 (填序号)
①加成反应 ②酯化反应 ③氧化反应 ④消去反应
(2)A分子中的官能团是(写名称) ,A的摩尔质量是
(3)写出④的化学方程式 。
(4)有机物“C8H8O8”因分子组成中含有三个国人心目中的吉利数字“8”而被称为“吉利分子”。由A转化而生成的“吉利分子”有多种不同的环状结构,写出其中的含一个六元环的有机物B结构简式 。
(5)一定量的A物质与乙醇的混合物完全燃烧生成27g水和VLCO2(标准状况),则等物质的量该混合物完全燃烧消耗氧气的物质的量为 。
19.(12分)A、B、C、D、E、F、G是常见的无机物,除B、C外其他物质的组成元素不超过2种,在水溶液中能发生如下反应:
① A+B→C+D ②C+E→A+H2O ③A+KI→F+D+G ④F+Cl2→A
⑤A+Fe→F
回答下列问题:
(1)写出下列物质的化学式:A ;B ;E 。
(2)写出反应③的化学方程式 。
(3)写出反应⑤的离子方程式 。
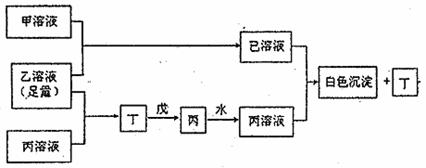 20.(14分)A、B、D是三种常见的短周期元素,它们的原子序数逐渐增大,B是第三周期中离子半径最小的元素,且其原子最外层电子数为D元素原子最外层电子数的一半。A元素最外层电子数比B多一个。甲、乙、丙是三种含氧酸的钠盐,甲中含B元素,乙中含C元素,丙中含A元素,甲、丙的水溶液均有较强的碱性,乙溶液pH小于7;丁为一种气体,戊为淡黄色固体。甲、乙、丙、丁、戊、己六种物质之间的相互反应关系如下图(图中略去了物质转化时的部分生成物)
20.(14分)A、B、D是三种常见的短周期元素,它们的原子序数逐渐增大,B是第三周期中离子半径最小的元素,且其原子最外层电子数为D元素原子最外层电子数的一半。A元素最外层电子数比B多一个。甲、乙、丙是三种含氧酸的钠盐,甲中含B元素,乙中含C元素,丙中含A元素,甲、丙的水溶液均有较强的碱性,乙溶液pH小于7;丁为一种气体,戊为淡黄色固体。甲、乙、丙、丁、戊、己六种物质之间的相互反应关系如下图(图中略去了物质转化时的部分生成物)

回答下列问题:
(1)写出A、B、D三种元素的元素名称 、 、 。
(2)写出戊的电子式 。丁与戊反应的化学方程式 。
(3)若乙溶液不足量,乙溶液分别和甲、丙溶液也能发生化学反应,但生成物不是乙和丁,写出不足量的乙溶液与甲溶液反应的离子反应方程式: 。
(4)定出乙、丙两溶液混合的离子方程式 ; 。
17.(6分)(1)下列有关化学实验的操作或说法中,正确的是(填写字母代号)
A.做沉淀反应实验时,检验已沉淀完全的操作是:在上层清液中(或取少量上层清液置于小试管中),滴加沉淀剂,如果不再产生沉淀,说明沉淀完全
B.进行中和热测定实验时,需要测出反应前盐酸与NaOH溶液的各自温度及反应后溶液的最高温度
C.检验红砖中的氧化铁成分时,向红砖粉末中加入盐酸,放置到充分沉淀后,取上层清液于试管中,滴加KSCN溶液2~3滴,观察现象。
D.配制一定物质的量浓度的溶液时,将称量好的溶质溶于盛有适量水的烧杯中,待溶解后立即倾入容量瓶中,然后洗涤玻棒和烧杯,并将洗涤液与转移到容量瓶中,摇匀后定容
E.分液时,先将下层液体从分液漏斗下口放出,然后再继续放出上层液体
(2)火箭可用肼(N2H4)作燃料,用NO2作氧化剂,两者反应成氮气和水,但NO2喷出时有部分来不及反应而被喷出,所以我们看到的火箭尾部总有一片桔红色的烟雾。
已知:N2(g)+2O2(g)=2NO2(g);△H=+67.6kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-534kJ/mol
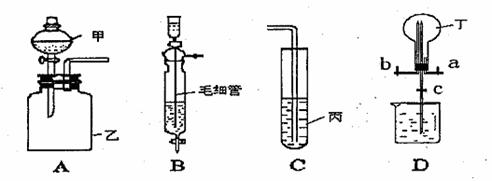 18.(16分)某化学兴趣小组的同学利用下图所示实验装置进行物质的制备、性质等实验(图中夹持装置均已省略)。请按要求填空,
18.(16分)某化学兴趣小组的同学利用下图所示实验装置进行物质的制备、性质等实验(图中夹持装置均已省略)。请按要求填空,
(1)利用A或B装置可制取的气体有 。(写出两种即可)
(2)已知KMnO4住常温下可与浓盐酸反应生成Cl2,请利用A、C装置设计一个简单的实验验证KMnO4、Cl2、Br2的氧化性强弱。在甲、乙、丙中加入的试剂分别装入 、 、 ,反应中若观察到广口瓶乙中的现象是 试管C中的现象是 ,则可证明氧化性的强弱为KMn O4>C l2>Br2
(3)B是利用浓硫酸和浓盐酸制备纯净HCl的装置,其中毛细管中充满的液体药品是
,装置中毛细管的作用是 。
(4)利用A、B、D三个装置可完成下列实验:
①在烧瓶丁中收集干燥的HCl气体:关闭c处止水夹,打开活塞a、b,将B、D装置相连,向圆底烧瓶丁中充入氯化氢气体,HCl应从丁的 (填a或b)端导管通入才能使气体集满。
②喷泉实验:关闭连接B、D装置的活塞,将A、D相连,缓慢通入与HCl等体积的另一种气体,可观察到有白烟生成,关闭该处活塞。打开水止夹c,立即看到烧瓶内出现喷泉现象,此时装置A的甲、乙中加入的试剂分别是 、 。
③若圆底烧瓶丁中仅集满氯化氢气体(标况下),也可进行喷泉实验。实验完毕以后,烧瓶中溶液的物质的量浓度是 。(不考虑溶质的扩散)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com